
题目列表(包括答案和解析)
3.下列说法正确的是 ( )
A.碘酒中的溶剂是水
B.把食用油放入水里,并用力振荡,食用油是溶质
C.高锰酸钾放入水中,生成紫色溶液
D.将少量氯化钠放入水中溶解,溶质是氯化钠
思路解析:此题必须记住溶液、溶质、溶剂的概念,理解溶液的均一性,稳定性的特征,才能做出正确选择。选项A、B不正确,碘酒是碘溶于酒精中,所以碘是溶质,酒精是溶剂;食用油不溶于水,两者混合,振荡,得到乳浊液,而不是溶液,所以不能说食用油是溶质;D项正确,氯化钠放入水中得到食盐水,所以溶液里的溶质是氯化钠;选项C正确,高锰酸钾易溶于水,虽然它的水溶液是紫色的,但是有均一性和稳定性。
答案:CD
2.(2006四川成都中考,5)各种洗涤剂广泛进入人们的生活中,下列洗涤中所用洗涤剂不具有乳化功能的是( )
A.用汽油除去衣服上的油污 B.用餐具洗洁精清洗餐具上的油污
C.用肥皂液洗衣 D.用沐浴露洗澡
思路解析:能够把油污转化成为均匀地悬浮在水中的小液滴的物质,具有乳化作用。一般具有乳化作用的是洗涤剂和洗衣粉、肥皂等。
答案:A
1.(2006安徽新课改区,7)在化学学习中,经常会遇到“1+1≠2”的有趣现象。下列选项符合此现象的是( )
A.n个N2与n个O2混合后得到的分子总数
B.100 mL酒精与100 mL水混合后溶液的体积
C.1 g饱和食盐水中加1 g水后所得溶液的质量
D.1 g氢氧化钠稀溶液和1 g稀硫酸溶液混合后所得溶液的质量
思路解析:溶液混合后总质量不变,但只要两溶液不完全相同(溶质或浓度),混合后溶液的体积发生变化。
答案:B
13.(2006江苏徐州中考,22) 溶液在生产和科研中具有广泛的用途。在农业上,为了选种子,需要配制15%的盐溶液。现有30 kg食盐固体,可配制食盐溶液____________kg。配制食盐溶液的一般步骤为①________________________,②________________________,③溶解。
解析:根据质量分数公式计算出溶液的质量=30 kg÷15%=200 kg。配制溶液的步骤一般为:①计算;②称量固体和量取液体;③溶解。
答案:200 计算 称量固体和量取液体
快乐时光
各有解释
一学生提出“打人与被打有何不同”,请教老师。历史老师:打人是侵略者,被打是受害者。英文老师:打人是主动式,被打是被动式。物理老师:打人是施力,被打是受力。教导主任:各记大过一次。
12.A、B两种固体物质的溶解度曲线如图所示。请完成下列问题:

(1)t1 ℃时,A物质的溶解度为____________ g。
(2)t2 ℃时,A、B两种物质的溶解度____________(填“相同”或“不同”)。
(3)我国有些地区有一种说法:“冬天捞碱,夏天晒盐。”这里的碱是指Na2CO3,盐是指NaCl。那么,图中____________(填“A”或“B”)的溶解度曲线与Na2CO3的溶解度曲线相似。
(4)人们用上述方法从盐湖中捞得的NaCO3会含有少量的NaCl。某研究性学习小组称取含NaCl的Na2CO3固体12.5 g,将其配制成溶液,再向其中逐滴加入足量的稀盐酸,使气体完全放出,共收集到4.4 g CO2气体,则原固体中Na2CO3的质量分数为____________%。
解析:(1)从曲线上可以查出;(2)两条曲线的交点是指在对应的温度下A、B两种物质的溶解度相等;(3)Na2CO3的溶解度受温度影响较大,而NaCl较小;(4)由化学方程式计算出Na2CO3的质量,再计算Na2CO3的质量分数。
答案:(1)a (2)相同 (3)A (4)84.8
11.海洋是巨大的资源宝库,从海洋中可提取许多重要物质。请你参与下列探究活动并完成有关问题:

(1)我市某盐场测得:①海水含NaCl约为3.5%;(即指溶质氯化钠的质量占整个溶液中质量的百分比为3.5%,下同)②在海边打深井;③井水中含NaCl约为8%。晒盐最好选择____________(填序号)作原料,理由是________________________。
(2)关于晒盐原理的说法正确的是____________。
A.利用阳光和风力,使氯化钠蒸发出来
B.利用阳光和风力,使水分蒸发,析出食盐
C.降低温度使氯化钠析出
D.日光照晒后,氯化钠的溶解度变小
(3)晒盐后得到的母液(又称卤水)中含有氯化镁(MgCl2)、硫酸镁(MgSO4)和氯化钾(KCl)等物质。参照图中各物质的溶解度曲线,从卤水中提取氯化钾晶体可采用下列方法:
①将卤水加热到60 ℃以上蒸发水分后,会逐渐析出____________(填名称)晶体,其理由是________________________。
②将①中的晶体过滤后,得到滤液,把滤液降温至30℃以下,又析出氯化钾晶体,然后用少量的____________(填“热水”或“冷水”)洗涤这两种晶体的混合物,就可以得到较纯的氯化钾晶体。
解析:氯化钠的溶解度受温度影响变化不大,应采用蒸发水分离出晶体。根据曲线图对比几种物质溶解度曲线的不同点后再进行判断。
答案:(1)② NaCl的质量分数大,经土层过滤后污染小 (2)B
(3)①硫酸镁 温度高于60 ℃后硫酸镁的溶解度随温度升高而减小 ②冷水
10.禽流感期间,某养殖户需配制2 000 g 2%(即指溶质氢氧化钠的质量占整个溶液中质量的百分比为2%)氢氧化钠溶液以给禽舍用具进行杀菌消毒。试计算完成:
(1)配制时需称取氢氧化钠固体____________ g,水____________mL(水的密度取1 g·cm-3)。
(2)用质量为23.1 g的烧杯为容器,在托盘天平上称取所需的氢氧化钠固体时,请在下表中选出所需的砝码(打“√”表示选用),并在图中选出能正确表示游码位置的选项(填序号)____________。
|
法码大小/g |
100 |
50 |
20 |
20 |
10 |
5 |
|
打“√”表示选用 |
|
|
|
|
|
|

解析:(1)根据公式“溶质质量=溶液质量×质量分数”和“溶剂质量=溶液质量-溶质质量”进行计算;(2)根据托盘天平使用的注意事项?思考。
答案:(1)40 1 960 (2)C
|
法码大小/g |
100 |
50 |
20 |
20 |
10 |
5 |
|
打“√”表示选用 |
|
√ |
|
|
√ |
|
9.如图所示,在常温下将一个塑料小球放入盛有饱和食盐水的烧杯中,塑料小球漂浮在食盐水中。

(1)现加入少量食盐晶体,充分搅拌和静置后,在温度不变的情况下,小球在液面沉浮有何变化?____________,并简述理由:________________________。
(2)若要在不用外力的情况下使小球略上浮,你准备采取的具体方法是___________________。
解析:饱和食盐水中再加入氯化钠晶体后,晶体不溶解,所以烧杯内溶液的密度不变,小球在液面上的沉浮情况不变。要想使小球上浮,就要设法使其溶液的密度增大。
答案:(1)沉浮情况不变 因为氯化钠晶体加入到氯化钠饱和溶液中,在温度不变的情况下,不会继续溶解,溶液的密度不变,小球排开液体的体积也不变
(2)升高温度后加入氯化钠晶体,使溶液的密度增大(或加入其他可溶性固体物质,如硝酸钾,使溶液的密度增大等)
8.已知20 ℃时KNO3的溶解度为31.6 g,溶解度曲线如右图所示。
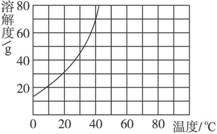
(1)20 ℃时,将25 g KNO3放入到100 g水里,搅拌,得到不饱和溶液。则该溶液中溶质的质量分数为____________。
(2)欲使其变为饱和溶液可采取的方法有:____________或____________或____________。
(3)20 ℃时,将35 g KNO3放入到100 g 水里,搅拌,得到的溶液是____________(填“饱和”或“不饱和”),该溶液中溶质的质量分数是____________。
解析:(1)依据溶质质量分数公式计算。
(2)不饱和溶液要变为饱和溶液,一般可采用:①加溶质;②蒸发溶剂;③降低温度的方法。
(3)从溶解度曲线可知,20 ℃时35 g KNO3放入到100 g水中KNO3不能全部溶解,得到饱和溶液,再用20℃时KNO3的溶解度31.6 g计算:31.6 g/(100+31.6) g×100%=24%。
答案:(1)20% (2)降低温度 蒸发溶剂 增加硝酸钾晶体 (3)饱和 24%
7.t℃时,分别向盛有10 g水的两支试管中,加入等量的甲、乙两种固体物质,使其充分溶解,可观察到如图所示的现象。


(1)t ℃时,____________(填“A”或“B”)试管中的溶液一定是饱和溶液。
(2)图中可表示甲物质的溶解度曲线的是____________(填“a”或“b”),要使A试管中剩余的固体继续溶解可采用____________或____________的方法。
解析:(1)根据饱和溶液与不饱和溶液的概念可判断A试管中的溶液一定是饱和溶液。
(2)从曲线图上可看出在t ℃时b的溶解度比a小,表示甲的是b;从曲线图上还可知b的溶解度随温度升高而增大,故溶质甲继续溶解,可采用升高温度或加水的方法。
答案:(1)A (2)b 加水 升高温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com