
题目列表(包括答案和解析)
5.物质的量相同浓度相同、体积相同的下列溶液中,吸收SO2 气体的量最多的是( )
A.氨水 B.碳酸钠 C.硫化钠 D.氢氧化钡
4.关于SO2和SO3的说法错误的是:①都是酸酐,②与水化合都能生成相应的酸,③都能与碱反应生成正盐或酸式盐,④通常条件下都是气体,⑤都有还原性 ( )
A.①④ B.④⑤ C.③⑤ D.②③
3.下列物质长久放置后,因被空气氧化而变质的是 ( )
A.NaOH溶液 B.Na2SO3溶液 C.澄清石灰水 D.氯
2.实验室制备SO2气体,下列方法可行的是 ( )
A.Na2SO3溶液与HNO3 B.Na2SO3溶液与稀盐酸
C.Na2SO3与H2S溶液 D.Na2SO3固体与浓H2SO4
1.酸雨有很大的危害。下列气体在空气中达到一定含量时,可形成酸雨的是 ( )
A.NH3 B.CO C.SO2 D.H2
23.(11分)有两种气态单质Am和Bn,已知2.4gAm和2.1gBn所含的原子个数相同,分子个数比是2:3,又知A和B的原子核内质子数都等于中子数,A原子内的L电子层所含电子数是K层电子数的3倍,则:
(1)A和B的元素符号分别是A_________ B__________
(2)Am中的m值是________,Am的同素异形体是__________。
(3)B的气态氢化物与B的最高价氧化物的对应水化物反应生成的化合物的化学式为
_ _______________。
(4)写出B元素与氢元素形成的10电子阳离子及Bn单质的电子式__________、_________。
22.(8分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)SiC Si; SiCl4 SiO2
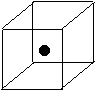 (2)右图立方体中心的“●”表示硅晶体中的一个原子,
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
21.(7分)A、B、C三种元素为短周期元素。A元素的阴离子不能被任何氧化剂氧化,则A离子的结构示意图为___________,它是_____离子。1 mol B单质能从盐酸中置换出3 g 氢气,此时B转变为与Ne原子具有相同电子层结构的离子,则B元素是_______;B的最高价氧化物的对应水化物的化学式为____________。C元素有3个电子层,且最外电子层比L电子层少2个电子,则C元素是__________;C与Na反应后生成物的电子式为________,化合物中的化学键属于____________。
20.(9分)W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。由此可知:
(1)写出元素符号:W为_________,X为________,Y为_________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为______________。
(3)由Y、X、W组成的物质中有_______键和_______键组成的_______化合物。
19.

 (8分)以下结构中, 代表原子序数从1到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2: )。
(8分)以下结构中, 代表原子序数从1到10的原子的原子实(原子实是原子除最外层电子后剩余的部分),小黑点代表未用于形成共价键的最外层电子,短线代表共价键(示例:F2: )。

A B C D
根据各图表示的结构的特点,写出该分子的化学式:
A_______________B______________C____________ D_________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com