
题目列表(包括答案和解析)
18.制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生反应2FeCl3+Cu====2FeCl2+CuCl2。FeCl3溶液跟铁粉也能反应2FeCl3+Fe====3FeCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A.烧杯中有铜无铁 B.烧杯中有铁无铜
C.烧杯中铁、铜都有 D.烧杯中铁、铜都无
[解析] FeCl3跟Fe、Cu都能反应,因铁的还原性比铜强,在氯化铁溶液中同时加入铁粉和铜粉时,首先被氧化的是Fe,即Fe+2FeCl3====3FeCl2,铁反应完后,铜被氧化:Cu+2FeCl3====2FeCl2+CuCl2。如无FeCl3,铁粉过剩,Fe还能跟CuCl2发生置换反应,故B项不可能。
[答案] B
19反应8NH3+3Cl2====6NH4Cl+N2中,被氧化的氨和未被氧化的氨的质量比是
A.3∶1 B.1∶3 C.1∶1 D.3∶8
[解析] 在反应中,8个NH3分子,只有2个变成N2,另6个变成NH4Cl未发生价变。
[答案] B
17.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:Cl-<Fe2+<H2O2<I-<SO2,则下列反应不能发生的是
A.2Fe3++SO2+2H2O====2Fe2++SO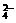 +4H+
+4H+
B.I2+SO2+2H2O====H2SO4+2HI
C.H2O2+H2SO4====SO2↑+O2↑+2H2O
D.2Fe2++Cl2====2Fe3++2Cl-
[解析] 判断的依据就是排查A-D中还原能力的顺序,看与题给信息是否吻合。
A中SO2>Fe2+;B中SO2>I-;C中H2O2>SO2;D中Fe2+>Cl-,故C不能发生。
[答案] C
16.有人预言:H2是21世纪最理想的能源,其根据不正确的是
A.生产H2的原料来源广阔
B.在等质量的可燃气体中,H2燃烧时放出的热量多
C.H2易液化,携带方便
D.燃烧时无污染
[答案] C
15.下列关于强、弱电解质的叙述正确的是
A.强酸、强碱及大部分盐类属于强电解质,弱酸弱碱属于弱电解质
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
D.SO2的水溶液能导电,所以SO2是电解质
[解析] B选项中所有的共价化合物都是弱电解质不对,如HCl、H2SO4等都是强电解质;D选项中SO2的水溶液能导电,是因为SO2跟水反应生成了电解质H2SO3,SO2本身无法电离。
[答案] A
14.对溶液中的离子反应,下列说法正确的是
①不可能是氧化还原反应 ②只能是复分解反应 ③可能是置换反应 ④不能没有分子参加
A.①③ B.③ C.①② D.③④
[解析]
此类练习,只要能迅速、准确地举出反例即可求出答案。①Zn+2H+====Zn2++H2↑是氧化还原反应所以①不正确;②不一定是复分解反应MnO2+4H++2Cl- Mn2++Cl2↑+2H2O;③正确例如①;④不正确,例如BaCl2+Na2SO4====BaSO4↓+2NaCl,无分子参加。
Mn2++Cl2↑+2H2O;③正确例如①;④不正确,例如BaCl2+Na2SO4====BaSO4↓+2NaCl,无分子参加。
[答案] B
13.下列离子方程式正确的是
A.碳酸钡溶于稀盐酸:CO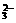 +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
B.铝和稀硫酸反应:2Al+6H+====2Al3++3H2↑
C.铜跟硝酸银溶液反应:Cu+Ag+====Cu2++Ag
D.氯化镁溶液跟NaOH溶液反应:Mg2++2OH-====Mg(OH)2↓
[解析] BaCO3难溶于水,不能改写成CO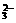 ;C项电荷不守恒。
;C项电荷不守恒。
[答案] BD
12.下列各组离子在溶液中可以大量共存的是
A.H+、SO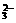 、CO
、CO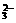 、SO
、SO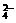 B.Cu2+、Cl-、NO
B.Cu2+、Cl-、NO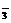 、CO
、CO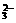
C.Mg2+、H+、SO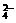 、Cl- D.Mg2+、OH-、CO
、Cl- D.Mg2+、OH-、CO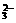 、H+
、H+
[解析] A选项中SO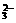 、CO
、CO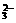 与H+;B选项中Cu2+与CO
与H+;B选项中Cu2+与CO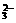 ;D选项中Mg2+与OH-、CO
;D选项中Mg2+与OH-、CO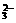 ,H+与OH-,H+与CO
,H+与OH-,H+与CO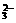 均不能大量共存。
均不能大量共存。
[答案] C
11.亚硝酸(HNO2)既可作氧化剂又可作还原剂,当它在反应中作氧化剂时,可能生成的产物是
A.N2 B.N2O3 C.NH3 D.NO2
[解析] 亚硝酸中N呈现+3价,当它作氧化剂得电子,化合价要降低。N2中N呈0价,N2O3中N呈+3价,NH3中N呈-3价,NO2中N呈现+4价。故还原产物可能是N2或NH3。
[答案] AC
10.有下列氧化还原反应:
①Fe+CuSO4====Cu+FeSO4
②Cu+2FeCl3====CuCl2+2FeCl2
③2KMnO4+16HCl====2KCl+2MnCl2+5Cl2↑+8H2O
④2FeCl2+Cl2====2FeCl3
根据上述反应可判断各粒子的氧化性由强到弱的顺序正确的是
A.MnO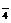 >Cl2>Fe3+>Cu2+>Fe2+ B.Cl2>MnO
>Cl2>Fe3+>Cu2+>Fe2+ B.Cl2>MnO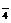 >Cu2+>Fe2+>Fe3+
>Cu2+>Fe2+>Fe3+
C.MnO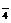 >Fe3+>Cu2+>Cl2>Fe2+ D.Fe3+>MnO
>Fe3+>Cu2+>Cl2>Fe2+ D.Fe3+>MnO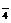 >Cl2>Cu2+>Fe2+
>Cl2>Cu2+>Fe2+
[解析]
根据“两强变两弱”比较方法,由①式知氧化性Cu2+>Fe2+,由②知氧化性Fe3+>Cu2+,③式知氧化性MnO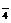 >Cl2,④式知氧化性Cl2>Fe3+,故A项正确。
>Cl2,④式知氧化性Cl2>Fe3+,故A项正确。
[答案] A
9.下列说法不正确的是
A.凡有单质参加的化合反应都是氧化还原反应
B.所有的复分解反应都是非氧化还原反应
C.盐酸在参加的反应中只能作氧化剂
D.金属在参加的反应中只能作还原剂
[解析]
盐酸中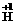
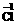 ,-1价Cl可失去电子被氧化,盐酸既可作氧化剂,也可作还原剂。金属在反应中只能失去电子作还原剂。
,-1价Cl可失去电子被氧化,盐酸既可作氧化剂,也可作还原剂。金属在反应中只能失去电子作还原剂。
[答案] C
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com