
题目列表(包括答案和解析)
①、不分步加溶液,而是加HCl和BaCl2混合溶液于待检液中,如果产生白色的沉淀,是否说明待检溶液中一定有SO42-离子存在?
答:否,因有Ag++Cl-=AgCl↓(白色)不溶解于HCl溶液。干扰离子是Ag+。
②、先加HNO3溶液酸化,后加Ba(NO3)2溶液,产生白色的沉淀,是否说明待检溶液中一定有SO42-离子存在?
答:因有
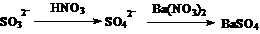
白色的沉淀可能是SO32-转化,干扰离子是SO32-。
③、先加Ba(NO3)2溶液,产生白色的沉淀,后加HNO3溶液酸化,白色的沉淀不溶解。是否说明待检溶液中一定有SO42-离子存在?
答:因有
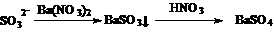
白色的沉淀可能是SO32-转化,干扰离子是SO32-。
④、先加Ba(NO3)2溶液,产生白色的沉淀,后加HCl溶液酸化,白色的沉淀不溶解。是否说明待检溶液中一定有SO42-离子存在?
答:和③比较:④中虽然加的是HCl溶液,但事前引入NO3-离子,在酸性环境下NO3-离子具有强氧化性。实际就是HNO3。故也有下列转化
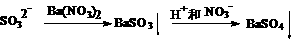
干扰离子是SO32-。
⑤、向待测液中加HCl和Ba(NO3)2混合溶液,产生不溶解的白色沉淀,是否说明待检溶液中一定有SO42-离子存在?
答:因有Ag++Cl-=AgCl↓(白色)不溶解于HCl溶液。干扰离子是Ag+。
另有
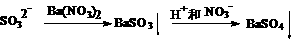
干扰离子是SO32-。
⑥、先加BaCl2溶液,产生白色的沉淀,后加HCl溶液酸化,白色的沉淀不溶解。是否说明待检溶液中一定有SO42-离子存在?
答:因有Ag++Cl-=AgCl↓(白色)不溶解于HCl溶液。干扰离子是Ag+。
3、正确检验方法是:
先加入HCl溶液,酸化待检溶液排除CO32-、SO32-、Ag+等离子。然后加入BaCl2或Ba(NO3)2溶液,如果有沉淀生成就说明有SO42-存在。
2、杂质干扰原理:
常见杂质有CO32-、SO32-、Ag+等离子。
①CO32-+Ba2+=BaCO3↓(白色)溶解于HCl和HNO3溶液。离子方程式是:
BaCO3+2H+=Ba2++H2O+CO2↑
②SO32-+Ba2+=BaSO3↓(白色)溶解于HCl溶液。离子方程式是:
BaSO3+2H+=Ba2++H2O+SO2↑
因HNO3溶液有强氧化性,能把BaSO3转化为BaSO4,都是白色沉淀。
③Ag++Cl-=AgCl↓(白色)不溶解于HCl和HNO3溶液。Ag+和SO42-不能大量共存。
1、SO42-检验的原理:
Ba2++SO42-=BaSO4↓(白色)不溶解于HCl和HNO3溶液。
25.元素周期表中前7周期的元素如下表所示:
元素周期表中前7周期的元素数目
|
周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |
(1)第6、7周期比第4、5周期多了14种元素,其原因是_____ ___。
(2)周期表中________族所含元素最多,________族元素形成化合物最多。
(3)请分析周期数与元素数的关系,预言第8周期最多可能含有元素种数为_____
A.18 B.32 C.50 D.64
24.(13分)A、B、C、D、E五种短周期元素,它们的质子数依次递增。A元素原子核外只有1个电子。B元素原子和C元素原子最外层电子数之差为2。B元素原子L层上的电子数为K层电子数的2倍。B、C、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色。0.5mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移。在E和C的化合物中,E的质量占52.94%,又已知E的原子核中有14个中子。
(1)写出五种元素的名称:
A___ __,B________,C________,D________,E________。
(2)画出D原子结构示意图、E阳离子结构示意图________ 、________。
(3)A2C的电子式为__ _____,BA4的结构式为________。
(4)五种元素中原子半径最小的是______,金属性最强的是_____。(填元素符号)
附加题:(10分)
23.(4分)氮化碳晶体是新发现的一种高硬度、高熔点的材料,该晶体的晶型应该是
晶体,试根据物质结构知识推测氮化碳晶体与金刚石晶体相比熔点较低的应是 。
22.(11分)现有①CaCl2 ②金刚石 ③NH4Cl ④NaOH ⑤冰醋酸 ⑥碘片 ⑦金刚砂
(SiC)⑧Ar 八种物质,按下列要求回答:((1)、(2)两题填序号)
(1)熔化时不需要破坏化学键的是________,熔化时需要破坏共价键的单质是________, 熔
点最高的是________,熔点最低的是________。
(2)属于离子化合物的是________,只有离子键的物质是________,晶体以分子间作用力
结合的是________。
(3)①的电子式是________,④的电子式是________。
21.(12分)下表标出的是元素周期表的一部分元素,回答下列问题:
|
1 |
|
|
|
|||||||||||||||
|
2 |
|
|
|
|
D |
|
B |
A |
|
|||||||||
|
3 |
J |
I |
H |
|
C |
G |
F |
E |
||||||||||
|
4 |
L |
K |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N |
|
|
5 |
|
|
|
|
|
|
M |
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1)表中用字母标出的14种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是_______,非金属性最强的是________,属于过渡元素的是_______(该空用字母表示)。
(2)B,F,C的气态氢化物中以_________最不稳定(填化学式)。
(3)除稀有气体外第三周期中原子半径最小的是_________(填元素符号)
(4)写出I、H号元素最高价氧化物的对应水化物的化学式:__________和_________。 碱性强弱顺序是_________>___________。
20.现在含有元素硒(Se)的保健品已经开始进入市场, 已知它与氧元素同族, 与钾元素同周期, 关于硒的说法中不正确的是 ( ) A. 原子序数为 34 B. 最高价氧化物的水化物的分子式为: H2SeO4 C. Se的非金属性比Br强 D. 气态氢化物的稳定性比硫化氢气体弱
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com