
题目列表(包括答案和解析)
21.(10分)A、B、C均为短周期元素,可形成A2C和BC2两种化合物。A、B、C的原子序数依次递增,A原子的K层的电子数目只有一个,B位于A的下一周期,它的最外层电子数比K层多2个,而C原子核外的最外层电子数比次外层电子数少2个。它们的元素符号分别为:A ___ ;B ____ ;
C __ ;B原子的结构示意图为 ;BC2的电子式
___________________.
20.(4分)在下列物质中(填序号)(A)Cl2 (B)NaI (C)H2S(D)CO2 (E)CaCl2 (F)N2(G)CCl4 (H)Na2O(I)NH3(J)HBr
(1)含离子键的物质是__________________;(2)含有共价键化合物的是
_________________________________。
20.(12分)已知B、D是淡黄色固体且D为单质,A与D反应生成离子化合物.有下面转化关系:



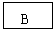


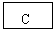
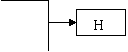







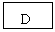
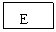
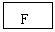
回答下列问题:
(1)写出C的电子式: _________,X的结构式____________。
(2)写出下列反应的离子方程式:
①B+H2O_______________________________________________________
②F+H2O_________________________________________________
(3)上述转化关系中有一个是可逆反应,则该反应的化学方程式为
________________________________________________________
(4)写一个化学方程式能证明D元素的非金属性小于Cl元素的非金属性_________________________________________________
(5)检验H溶液中阴离子的实验操作和实验现是____________
_______________________________________________________
________________________________________________________21.(10分)一定量的Zn与100ml18.5mol/L的浓硫酸充分反应,ZN完全溶解,同时在标准状况下生成33.6L气体A,将反应后的溶液稀释至1L,测得溶液中C(H+)=0.1mol/L,则:
(1)气体A的组成成份为____________________(填化学式)
(2)写出有关的化学方程式________________________________
________________________________________________________
(3)气体A中各组成成份体积比为____________________________
(命题:江安中学化学组 魏旭)
19.
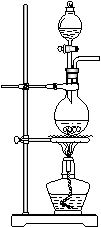 (13分)据下图回答
(13分)据下图回答
 :
:
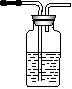
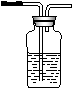
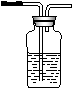
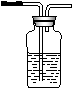
 A
A
B C D E
(1)写出木炭与浓硫酸反应的化学方程式_____________________
(2)如果用图中的装置检验上述反应的全部产物,写出下面装置应加入的试剂名称及作用:
①A中加入的试剂是_________,作用是_______________________
②B中加入的试剂是_________,作用是_______________________③E中加入的试剂是__________,作用是_____________________
(3)实验时,C中若加入的是溴水,则C中发生反应的离子方程式为_____________________________________
18.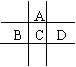 (8分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
(8分)有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同,回答下列问题:
(1)画出A离子的结构示意图:______________
(2)B在元素周期表中的位置是_________________
(3)C单质在A单质中燃烧的反应现象是_______________________
B单质在D单质中燃烧生成物的化学式为__________________
(4)A与E形成的化合物的化学式是______________,它的性质决定了它在物质的分类中应属于______________,与强碱溶液反应的离子方程式为_________________________________
17.(9分)在原子序数为1─18号元素中:(填元素符号或化学式)
(1)与水反应最剧烈的金属元素是________
离子方程式为__________________________________
与水反应最剧烈的非金属元素是________
化学方程式为___________________________________
(2)第三周期中原子半径最大的金属元素是_______________,元素的最高价氧化物所对应的水化物酸性最强的化合物是___________。(3)能吸收紫外线对地球起保护的物质是_________
16. 向一定量的浓H2SO4溶液中加入Wg的铜片并加热,充分反应后,得到V LSO2气体,则被还原的H2SO4不可能是
A. 98V/22.4g B. 98V/34g C. W/64mol D. W/32mol
 第I卷答案
第I卷答案
 1 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
|
|
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
|
|
|
|
|
|
|
|
第II卷非选择题(共52分)
15.用30ml 0.1mol/L Na2SO3溶液恰好将0.002molXO4-还原,则X元素在还原产物中的化合价为( )
A.+1 B.+2 C.+3 D.+4
14.下列变化的实质相似的是:
A.浓H2SO4和浓HCl在空气中敞口放置时浓度均减小. B.SO2和Cl2均能使品红溶液褪色. C.浓H2SO4和稀硫酸与锌反应均生产气体. D.HBr,HI气体不能用浓H2SO4制取
13.下列反应的离子方程式正确的是:
A. 将SO2通入Ca(ClO)2溶液中:
SO2 + H2O + Ca2+ + 2ClO- = CaSO3↓+ 2HClO
B. 氯气溶于水:Cl2 + H2O = 2H+ + Cl- + ClO-
C. 向Ba(OH)2溶液中逐滴加入NaHSO4溶液至刚好沉淀完全:
Ba2+
+ 2OH-+ 2H+
+ SO = BaSO4↓+2H2O
= BaSO4↓+2H2O
D.用NaOH溶液吸收尾气Cl2: Cl2 + 2OH-= Cl-+ClO-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com