
题目列表(包括答案和解析)
5.可以用来断定碳酸氢钠粉末中是否混有碳酸钠的实验方法是 ( )
A.加热时有无色气体放出
B.滴加盐酸时有无气泡放出
C.溶于水后,滴加稀的氯化镁溶液有无白色沉淀生成
D.溶于水后,滴加澄清石灰水,有无白色沉淀生成
4.下列说法中不正确的是 ( )
A.Na2CO3 和NaHCO3均可与HCl反应
B.Na2CO3比NaHCO3易溶于水
C.Na2CO3的稳定性比NaHCO3强
D.Na2CO3能与石灰水反应而NaHCO3不反应
3.下列关于碳酸钠和碳酸氢钠的比较中,正确的是 ( )
A .二者在水中的溶解度不同,碳酸氢钠的溶解度大于碳酸钠的溶解度
B .二者热稳定性不同,碳酸钠的热稳定性大于碳酸氢钠的热稳定性
C.二者都能与盐酸反应放出二氧化碳气体,但产气量和反应快慢不同
D .二者在一定的条件下可以相互转化
2.关于NaHCO3的性质,下列说法正确的是 ( )
A.和酸反应放出等量的CO2所消耗的酸比Na2CO3少
B.相同温度下溶解度比Na2CO3要大
C.热稳定性比Na2CO3强
D.NaHCO3只能和酸作用不能和碱作用
1.不能用来鉴别Na2CO3和NaHCO3的方法是 ( )
A.分别加热 B.加澄清石灰水 C.加稀盐酸 D.加BaCl2
18.(11分)计算题
(1)计算下列三种方法所配制的碳酸钠溶液的物质的量浓度(均用蒸馏水配制)
①用0.53g Na2CO3配成20ml溶液
②用1.43g Na2CO3·10H2O配成20ml溶液
③用1ml 5 mol/L Na2CO3溶液配成20ml溶液
(2)比较上述三种方法配制的结果,并分析其原因
17、(14分)用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是
(从下列中选用 A. 10ml B. 25ml C. 50ml D. 100ml)
(2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
16、(15分)氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
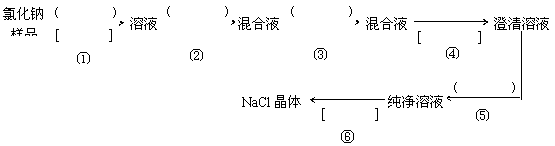
写出有关反应的化学方程式:
第②步
第③步
第⑤步
15、(4分)有两瓶C Cl4和水都是无色液体,只用试管,不用任何其它试剂,如何鉴别?简要写出实验方案
;
14、用NA表示阿伏加德罗常数,下列叙述正确的是
A. 64g SO2含有氧原子数为1NA
B. 物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为1NA
C. 标准状况下,22.4L H2O的分子数为1NA
D. 常温常压下,14g N2含有分子数为0.5NA
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com