
题目列表(包括答案和解析)
5.氧化还原反应的实质是( )
A.分子中的原子重新组合 B.氧元素的得失
C.电子的得失或共用电子对的偏移 D.化合价的改变
4.某学生用托盘天平称量氯酸钾晶体4.6g(1g以下只能用游码),但在操作时将药品和砝码所应放置的位置颠倒了,则称得的氯酸钾晶体的质量实际应是( )
A.3.6g B.5.6g C.4.8g D.3.4g
3.下列酸、碱中和反应中,可以用“H++OH-=H2O”表示的是( )
A.HNO3+KOH B.CH3COOH+NaOH
C.H2SO4+Cu(OH)2 D.HCl+NH3·H2O
2.在MnO2+4HCl(浓) 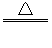 MnCl2+Cl2↑+2H2O的反应中,被氧化的HCl与参加反应的HCl质量关系是( )
MnCl2+Cl2↑+2H2O的反应中,被氧化的HCl与参加反应的HCl质量关系是( )
A.两者质量相等 B.后者是前者的3倍
C.前者是后者的1/2 D.前者是后者的1/4
1.下列反应中,反应物中各种元素都参加氧化还原反应的是( )
A.2KClO3 2KCl+3O2↑
B.CuO+H2
2KCl+3O2↑
B.CuO+H2 Cu+H2O
Cu+H2O
C.2AgNO3=2Ag+2NO2↑+O2↑ D.Cl2+H2O=HCl+HClO
5.30mL可能由CO、CO2和O2组成的混合气体与足量Na2O2充分反应,气体体积变为25mL,引燃此剩余气体,恢复到原始温度测得体积为20mL.试分析原混合气体的组成.
4.取50mLNa2CO3和Na2SO4的混合溶液,加入过量BaCl2溶液后得以14.51g白色沉淀,用过量稀硝酸处理后沉淀量减少到4.66g,并有气体放出,试计算:(1)原混合溶液中Na2CO3和Na2SO4的质量;(2)产生的气体的质量.
3.将一定质量的Na2CO3和NaHCO3混合物灼烧至恒重,将放出的气体通入足量的Ca(OH)2饱和溶液中,充分反应后得到的沉淀的质量是1.0g,加热后剩余的固体物质与足量的稀盐酸反应,收集到2.2g气体.计算原固体混合物中Na2CO3与NaHCO3的质量.
2.在48.9g水中投入1.15g金属钠,二者充分反应(假设反应过程中水无损失).试求所得溶液中NaOH的质量分数.
1.一定质量的金属钠放在干燥的空气中,一段时间后,变为0.6g某物质,0.6g该物质放入水中后得一溶液,此溶液可被含0.73gHCl的盐酸恰好中和.试计算0.6g某物质中各组分的质量.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com