
题目列表(包括答案和解析)
4.冶炼金属一般有下列四种方法:①焦炭法、②水煤气(或CO、或H2)法、③活泼金属置换法、④电解法,四种方法在工业上均有应用。
古代有:(Ⅰ)火烧孔雀石[Cu2(OH)2SO4]炼铜;(Ⅱ)湿法炼铜。
现代有:(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石[MgCl2·6H2O]中炼镁。
对上述冶炼方法的相关归类不正确的是
A.(Ⅰ)① B.(Ⅱ)② C.(Ⅲ)③ D.(Ⅳ)④
3.下列分子的比例模型中,中心原子上存在孤对电子的是
A. B.
B.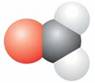
C. D.
D.
2.上世纪90年代初,国际上提出了“预防污染”这一新概念,绿色化学是“预防污染”的基本手段,下列各项中属于绿色化学的是
A.处理废弃物 B.治理污染点 C.减少有毒物 D.杜绝污染源
1.2007年6月,“八国峰会”再次就温室气体减排问题展开磋商并初步达成共识。为减少二氧化碳这种温室气体的排放,下列措施不切实际的是
A.大力开发氢能源 B.充分利用太阳能
C.不使用含碳能源 D.提高能源利用率
30、(6分)将含过量氧气和乙烯及某烷烃组成的混合气体20L,点燃爆炸反应后,气体体积仍为20L(120℃,1.01×105Pa),然后将气体通过足量的碱石灰,剩余气体2L,若仅通过浓硫酸,则体积变为10L。求烷烃的分子式及原来乙烯的体积。
29、(6分)在1.01×105Pa 120℃条件下,将1L丙烷和若干升O2混合点燃,燃烧后,恢复到原来的状态,测得混合气体的体积为m L,将燃烧后的气体再通过碱石灰,气体剩余n L,已知m-n=a,请分析后填写下列空白:
(1)若a=6,则n L气体成分只能是 。
(2)若燃烧前后始终保持1.01×105Pa和120℃,则a的最大值为 ,你确定该最大值的理由是 。
28、(4分)现代原子结构理论认为,在同一电子层上,可有s、p、d、f、g、h……等亚层,各亚层分别有1、3、5、……个轨道。试根据电子填入轨道的顺序预测:
(1)第八周期共有 种元素;
(2)根据“稳定岛”假说,第114号元素是一种稳定同位素,半衰期很长,可能在自然界都可以找到。试推测第114号元素属于 周期, 族元素,原子的外围电子构型是 。
27、(8分)1932年美国化学家鲍林首先提出电负性的概念。电负性(用X表示)也是元一种衡量元素金属性和非金属的重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:请仔细分析下表数据,回答下列有关问题:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
① 预测周期表中电负性最大的元素应为____________;估计钙元素的电负性的取值范围:___________< X <___________。
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为______________,其理由是___________________________________________________。
26、(8分)按构造原理写出35号元素的基态原子的电子排布式:__________ __;其所在主族的价电子层轨道表示式为___ __;最高正化合价为: __;其简单离子的电子式 。
25、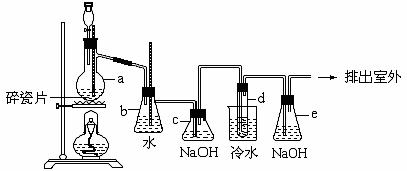 1,2-二溴乙烷(CH2BrCH2Br)可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水。在实验中可以用如下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,乙醇和浓硫酸反应时只有达到170℃才会大量产生乙烯气体,同时溶液常常会变黑,试管d中装有浓溴(表面覆盖少量水)。
1,2-二溴乙烷(CH2BrCH2Br)可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水。在实验中可以用如下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,乙醇和浓硫酸反应时只有达到170℃才会大量产生乙烯气体,同时溶液常常会变黑,试管d中装有浓溴(表面覆盖少量水)。
试回答下列问题:
(1)写出本题中制备1,2-二溴乙烷的两个化学方程式:
, 。
(2)安全瓶b可以向上倒吸,并可以检查实验进行时试管d中是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(3)写出容器c中NaOH溶液的作用 。
(4)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com