
题目列表(包括答案和解析)
23.(12分)全球海水中溴的藏量丰富,约占地球溴总藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65mg/L。其工业提取方法有:
(1)空气吹出纯碱吸收法。方法是将氯气通入到富含溴离子的海水中,使溴置换出来,再用空气将溴吹出,用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质。该方法涉及到的反应有:① (写出离子方程式);②Br2+3CO32-=BrO3-+ 5Br-+3CO2↑;③BrO3-+ 5Br-+6H+=3Br2+3H2O。其中反应②中氧化剂是 ;反应③中氧化剂是 。
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,使溴转化为氢溴酸,然后再用氯气氧化氢溴酸即得单质溴。写出溴与二氧化硫反应的离子反应方程式:_ ______________ __。
(3)溶剂萃取法。该法是利用单质溴在水中和溶剂中溶解度的不同的原理来进行的。实验室中萃取用到的实验仪器名称是 。下列可以用于海水中溴的萃取试剂的 。
①乙醇 ②四氯化碳 ③硝酸 ④直馏汽油
22.(9分)有A、B、C、D、E、F 6种元素,A、B、C、D、E的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。F的离子遇到SCN-变红色。
(1)A是________,B是________,C是________,D是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的电子排布____________________ 。
(4)写出F原子的电子排布式 ,原子结构示意图 。
21.(14分)实验室用燃烧法测定某氨基酸(CxHyOzNp)的分子组成,取wg该氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2。现用下图装置进行实验,回答问题:
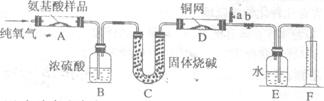
(1)实验中止水夹a是关闭的,b是开启的。但是实验开始时,首先要打开a,关闭b,通一段时间的纯氧,这样做的目的是 。
(2)以上装置中需要加热的有(填装置代号) 。操作时应该先点燃 的酒精灯。
(3)装置A中发生反应的化学方程式是 。
(4)实验中测得N2的体积为Vml(已换算为标准状况),为确定此氨基酸的分子式,还需要得到的数据有 (填字母)。
A.生成CO2气体的质量 B.生成水的质量
C.通入氧气的体积 D.该氨基酸的相对分子质量
(5)如果将装置B、C的连接顺序变为C、B,该实验的目的能否达到? ,
理由是 。
20.(5分)某化工厂排放的污水中含有Mg2+、Fe3+、Cu2+、Hg2+四种离子。甲、乙、丙三位学生分别设计了从该污水中回收纯净的金属铜的方案。


|
|
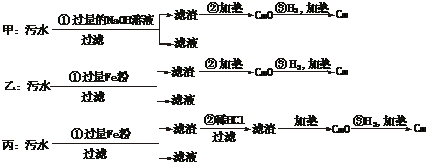
①甲、乙、丙提出的实验方案是否能得到纯净的金属铜?
甲____________,乙_________,丙___________。(填“能”或“不能”)
②在能制得铜的方案中,哪一步操作会导致环境污染?_________________。应增加哪些措施防止污染? 。
19.(3分,多选或少选均不得分)下列有关操作中正确(或能获得成功)的是_________
①为迅速除去乙酸乙酯中少量的乙酸,可加入足量的NaOH溶液并加热。
②向蔗糖溶液中加入3-5滴稀硫酸,水浴加热后,加NaOH溶液至碱性,再加入新制备的Cu(OH)2悬浊液,可以看到有砖红色沉淀生成。
③分离酒精与乙酸的混合物先用NaOH溶液中和,蒸馏;剩余物再与硫酸反应,再蒸馏
④配制银氨溶液时,将稀AgNO3溶液慢慢加到稀氨水中,直至沉淀恰好溶解为止。
⑤用乙醇,冰醋酸和6mol/L的H2SO4共热可制乙酸乙酯
⑥蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
18.下列粒子中,电子排布式为1s22s22p63s23p6的有
A.Sc3+ B.Mg2+ C.Cl- D.Br-
第Ⅱ卷(非选择题 共56分)
17.以下基态原子的电子排布式不符合构造原理的是
A.1s22s22p63s23p63d74s2 B.1s22s22p63s23p63d54s1
C.1s22s22p63s23p63d104s2 4p1 D.1s22s22p63s23p64s2
16.构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是
A.E(4s)>E(3s)>E(2s)>E(1s) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(5s)>E(4f)>E(4s)>E(3d) D.E(5s)>E(4s)>E(4f)>E(3d)
15.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
14.下列物质可用来鉴别乙酸溶液和乙醇的是
A.稀盐酸 B.石蕊试液 C.氯化钠溶液 D.碳酸钠溶液
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com