
题目列表(包括答案和解析)
33.将1.05g铝和过氧化钠的混合物放入一定量的水中,充分反应后固体无剩余。再向其中加入50mL 1 mol·L一1的盐酸,可恰好使反应过程中产生的沉淀消失。求原混合物中铝、过氧化钠各多少克?
32.把2.3g钠投入足量水中,充分反应后所得溶液用水稀释至100mL。求:
(1)生成标准状况下的氢气多少升?
(2)所得的溶液物质的量浓度?
31.为了证明稀硝酸与铜反应的气体产物是NO,某同学设计了如下实验装置和实验方案。
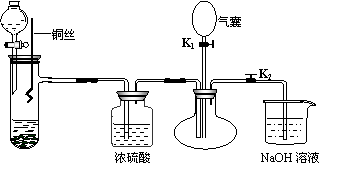
实验步骤:
⑴关闭K1,打开K2,向试管中加石灰石,通过分液漏斗向其中加入一定的稀硝酸,则加入石灰石的作用是 ,反应离子方程式是 。
⑵将将铜丝插入稀硝酸中,微热大试管。该步反应离子方程式是 。
⑶充分反应后,打开开关K1,通过气囊鼓入空气,可以观察到烧瓶中 ,证明稀硝酸与铜反应的气体产物是NO。
⑷NaOH溶液的作用 。
30.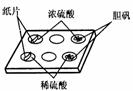 某学生做浓硫酸性质的实验:
某学生做浓硫酸性质的实验:
实验一:在一个白色的点滴板的孔穴中分别放入小纸片、少量CuSO4·5H2O。
然后如图所示,分别滴入几滴浓硫酸或稀硫酸,观察现象。
回答下列问题:
(1)浓硫酸滴入小纸片上,小纸片变 ________(填实验现象),说明浓硫酸具有_____性。
(2)浓硫酸滴入CuSO4·5H2O中,胆矾由_____(填实验现象),说明浓硫酸具有____性。
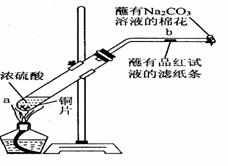 实验二:如右图所示,回答下列问题:
实验二:如右图所示,回答下列问题:
(3)写出a处反应的化学方程式,并用双线桥标明电子转移
的方向和数目________________________。
(4)一段时间后,b处滤纸条的变化为___________。
待试管中反应停止后,给b处滤纸微微加热,则滤纸条的
变化为 _____。
29. 在下图各物质的相互转化关系中:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色;G为白色沉淀;H为红褐色沉淀;B溶液焰色反应显黄色。(图中部分反应条件及生成物未全部标出)
在下图各物质的相互转化关系中:甲、乙、丙为三种金属单质;A、C、D常温下为气体,其中C呈黄绿色;G为白色沉淀;H为红褐色沉淀;B溶液焰色反应显黄色。(图中部分反应条件及生成物未全部标出)
填写下列空格:
(1)已知甲原子的质量数为23,写出甲原子的原子符号
(2)乙元素原子的结构示意图为 。
(3)F的化学式 。
(4)写出B与乙反应生成A的离子反应方程式 _________
(5)写出反应①的化学反应方程式: ________ __
28.回答下列关于铁元素及其化合物的知识:
为了检验某未知溶液是否是FeCl2溶液,两位同学分别设计了以下实验方案加以证明。
方案一:向一支装有该未知溶液的试管中先通入氯气,再滴加KSCN溶液,溶液呈现
红色,证明该未知溶液是FeCl2溶液。
方案二:向一支装有该未知溶液的试管中先滴加KSCN溶液,无现象,再通入氯气,
溶液变为红色,证明该未知溶液是FeCl2溶液。
回答以下问题:
⑴你认为哪个方案最合理 。
⑵写出FeCl2溶液中通入氯气反应的化学方程式
27.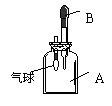 如图所示装置,集气瓶A中装满NH3,胶头滴管B中装满溶有酚酞的水,
如图所示装置,集气瓶A中装满NH3,胶头滴管B中装满溶有酚酞的水,
挤压胶头滴管B,可以看到现象 ,
产生上述现象的原因是 。
26.合理利用化学反应可以造福人类。请写出下列反应的化学方程式:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
⑴工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为:
。
⑵漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为 。
⑶反应⑴和反应⑵中,属于氧化还原反应的是(填编号) 。
25.10mL浓硝酸和1.92克铜反应,铜完全溶解,生成的气体颜色由深变浅(生成NO2、NO),
共收集到1.12L气体(标准状况),剩余酸用NaOH中和,共耗去1mol/L氢氧化钠10mL。
则浓HNO3物质的量浓度为 ( )
A、5mol/L B、9mol/L C、11mol/L D、12 mol/L
24.往100mL 0.1mol/L氯化铝溶液中逐滴加入氢氧化钠溶液,下列各选项能正确表示加入氢氧化钠体积(V)与生成沉淀质量(m)的关系是: ( )
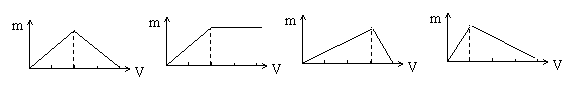
A、 B、 C、 D、
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com