
题目列表(包括答案和解析)
根据混合物中各物质溶解性、沸点、被吸附性能及在不同溶剂中溶解性的不同,可以选用过滤和结晶、蒸馏(或分馏)、纸上层析、萃取和分液等方法进行分离和提纯。
|
分离提纯方法 |
适用范围 |
实例 |
|
过滤 |
固体与液体不互溶的混合物 |
粗盐的提纯 |
|
结晶与重结晶 |
 混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 |
分离NaCl和KNO3的混合物 |
|
蒸馏(分馏) |
①难挥发的固体杂质在液体中形成的混合物 ②互溶液体沸点有明显差异 |
蒸馏水、无水乙醇的制备、石油的分馏 CCl4(沸点76.75℃)和甲苯(沸点110.6℃)混合物的分离 |
|
层析 |
被吸附能力不同的物质的分离 |
红、蓝墨水混合物中的不同色的分离 |
|
分液 |
两种互不混溶的液体混合物 |
CCl4和水的分离 |
|
萃取 |
溶质在互不相溶的溶剂里溶解度不同 |
利用CCl4从溴水中萃取溴 |
注意:不同的分离方法都有一定的适用范围,要根据不同混合物的性质选择合适的方法进行分离,且有时需要多种方法配合使用。
2.解决环境问题需要化学科学
⑴ 二氧化硫 的排放是造成硫酸型酸雨的主要原因,为减少硫酸型酸雨对环境造成的危害,采用 石灰石-石膏法 、 氨水法 燃煤烟气脱硫,既可以消除燃煤烟气中的二氧化硫,同是时还可以得到副产品 石膏 和 硫酸铵 。
⑵汽车发动机燃油排放的尾气中 CO、NO、NO2、碳氢化合物、颗粒物 造成的空气污染,破坏了生态循环。为消除汽车尾气所造成的污染,所采取的措施有:在石油炼制过程中进行 脱硫处理 ;发明了汽车尾气 催化净化转化装置 ,使尾气中的 CO、NO 在催化剂的作用下转化为无害的 N2、CO2和H2O 排出;用新的无害的汽油添加剂代替 四乙基铅 抗震剂;使用 酒精、天然气 代替部分或全部燃油;使用 氢 作汽车燃料,实现 “零排放” 。
⑶大气中二氧化碳的浓度不断增加, 温室效应 日益严重,为此,科学家研究并发现:二氧化碳和 环氧丙烷 在催化剂作用下可生成一种 可降解塑料 。
⑷从根本上解决环境和生态问题,要依靠 “绿色化学” ,绿色化学要求利用化学原理从源头上消除无污染,期望在化学反应和化学工业过程中充分利用参与反应的原料,所有物质原料、中间产物都在内部循环、利用,实现“零排放”。
1.现代科学技术的发展离不开化学
⑴一些科学家认为: 化学合成和分离技术 是人类生存所必需的,是 信息技术 、 生物技术 、 核科学和核武器技术 、 航空航天和导弹技术 、 激光技术 、 纳米技术不可或缺的物质基础。
⑵在了解 光合作用 、 固氮作用机理 和 催化剂理论 的基础上,可以期望实现农业的工业化,在工厂中生产粮食和蛋白质,使人类的生活质量大大提高。
2.化学是人类创造新物质的工具
⑴在化学科学的发展过程中,科学家积累了物质制备的一系列方法,特别是随着现代 合成技术 、 分离和检验技术 的发展,人们己经能够设计并创造出符合需要的新物质。
⑵电解原理的发现,电解技术的进步提高了食盐的利用价值: 电解熔融食盐 可以得到活泼的金属钠,而 电解饱和食盐水 得到的是烧碱、氯气、氢气,利用 氢气在氯气中燃烧 则可制得盐酸。
⑶20世纪以来, 合成氨 、 合成尿素 、 合成抗生素 等技术的相继发明,高分子的化学合成、新材料的屈出不穷、分离技术不断改进,使人类的生活水不不断提高。
1.化学是打开物质世界的钥匙
⑴19世纪,化学科学理论建立了以 原子论 、 分子结论 和 原子价键理论 为中心内容的经典原子分子论;发现了 元素周期律 ;提出了 质量守恒定律 ,奠定了化学反应动力学基础;人工合成 尿素 ,彻底动摇了“生命力论”,使有机化学得到迅猛发展。
⑵化学家鲍林,提出了 氢键理论 和 蛋白质分子的螺旋结构模型 ,为DNA分子双螺旋结构模型的提出奠定了基础。
⑶人类对酸碱的认识:
①酸碱电离理论:1883年,瑞典家阿伦尼乌斯创立了电离学说,提出 电解质电离时产生的阳离子全是氢离子的 是酸, 电解质电离产生的阴离子全是氢氧根离子的 是碱, 电解质电离时既产生氢离子又产生氢氧根离子 是两性物质;
②酸碱质子(H+)理论:1923年,又有化学家提出了在非水溶液中和无水条件下适用的酸碱理论,凡能 给出质子的物质 都是酸,凡能 接受质子的物质 都是碱, 既能给出质子又能接受质子的物质 是两性物质。
5.蛋白质和氨基酸
⑴蛋白质在某些 浓无机盐溶液 中,会产生 盐析现象 ,利用这一性质可以对蛋白质进行 分离或提纯 ;
⑵蛋白质在 热、强酸、强碱、重金属盐、紫外线、X光、福尔马林、酒精等 作用下,会发生 变性 ,失去生理功能,利用这一性质可以进行 杀菌消毒 。
⑶氨基酸的结构:氨基酸分子中至少含有一个 一COOH 和一个 一NH2 。α-氨基酸中至少有一个 氨基 一个 羧基 连在 同一个碳原子 上。
专题四:化学科学与人类文明
4.糖类
常见的糖类有:葡萄糖、蔗糖、麦芽糖、淀粉和纤维素。其是 和 是同分异构体, 和 不同同分异构体。
⑴葡萄糖具有还原性:能与 银氨溶液 发生银镜反应;和 新制的氢氧化铜悬浊液 反应产生 红色的氧化亚铜沉淀 。
⑵淀粉溶液遇 碘水 会变蓝,而纤维素则不能,但它们都水解得到 葡萄糖 。
⑶为检验淀粉的水解程度,在加入银氨溶液或新制的氢氧化铜悬浊液之前都应加入 氢氧化钠溶液 ,目的是为了 中和硫酸 。
3.酯和油酯
油酯的水解反应:在酸性条件下,水解生成 高级脂肪酸 和 甘油 ;在碱性条件下,水解生成 高级脂肪酸钠盐(硬脂酸钠) 和甘油。
2.乙酸的分子为 ,结构简式为 ,羧酸的官能团是 。
⑴乙酸是一元有机 弱酸 ,但其酸性比碳酸要 强 ,能使 紫色石蕊试液 变红。
⑵乙酸和乙醇在浓硫酸做催化剂,并加热条件下,发生酯化反应(也是“取代反应”):其中乙酸去 ,乙醇去 ,其反应方程式可表示为:
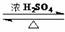 CH3CO18OH+CH3CH2OH CH3COOCH2CH3+H218O
CH3CO18OH+CH3CH2OH CH3COOCH2CH3+H218O
①浓硫酸的作用是: 催化剂 和 吸水剂作用 ;
②饱和碳酸钠的作用是:净化乙酸乙酯,便于分离提纯乙酸乙酯,其分离方法是 分液 ;
③为防止在加热时发生暴沸,在反应混合物中应加入 沸石或几块碎磁片 ;
④兼具凝作用的长导管不能插入液面下的原因是:防止加热不均产生 倒吸 现象。
1.乙醇的分子式为 、结构简式为 、醇的官能团是 。
⑴乙醇与是 CH3-O-CH3 同分异构体
⑵乙醇在有催化剂存在时,并在加条件下,能被氧气氧化成 CH3CHO ,并进一步氧化成 CH3COOH 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com