
题目列表(包括答案和解析)
13、在同一条件既可以向正反应方向进行,又可以向逆反应方向进行的化学反应
1、C 2、B 3、D 4、B 5、C 6、B 7、C 8、A 9、A 10、B 11、B 12、C
18.把6 molA气体和5 molB气体混合放入4L密闭容器中,在一定条件下发生反应:
3A(g)+B(g)  2C(g)+xD(g),经5min达到平衡,此时生成2molC,测得D平均反应速率为0.15 mol·(L·min)-1 ,求;(1)平衡时A的物质的量浓度.(2)B的转化率.(3)x的值 .
2C(g)+xD(g),经5min达到平衡,此时生成2molC,测得D平均反应速率为0.15 mol·(L·min)-1 ,求;(1)平衡时A的物质的量浓度.(2)B的转化率.(3)x的值 .
2-1-2 化学反应限度
17,氯气能与水反应,但在实验室制氯气时,可以排饱和食盐水的方法收集,为什么?
13,可逆反应是指
14,化学平衡状态是指 反应在 下,反应进行到一定程度时,
和 相等, 与 的浓度 的状态。
15,已知氯水中存在如下平衡:Cl2+H2O
 HCl+HClO
HCl+HClO
(1) 常温下,在一个体积为50ml的针筒里吸入40ml Cl2 , 再吸进10mL水,写出针筒中可能观察到的现象
(2) 若将此针筒长时间放置,有可看到什么变化?
试用平衡移动的观点加以解释
16,在20℃时,将a molH2(g)和b mol I2 (g) 充入到体积为VL的密闭容器中,发生反应:
H2(g)+I2(g)  2HI(g)
2HI(g)
(1)反应刚开始时,由于C(H2)= , mol.L- C(I2)= mol.L- 而C(HI)= mol.L- 所以化学反应速率 最大,而 最小(为零)
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为 c(H2) , c(I2) 而c(HI) 从而使化学反应速率V正 而V逆 (填逐渐增大或逐渐减少)
(3)当反应进行到V正与V逆 时,此反应就达到了平衡状态,若外界条件不变时,反应混合物中各组分的物质的量、物质的量浓度、质量分数、体积分数、反应物的转化率等都将
1,当可逆反应2SO2+O2 2SO3 达到一定限度后通入18O2,再经过一段时间,18O存在于( )
2SO3 达到一定限度后通入18O2,再经过一段时间,18O存在于( )
A、SO3, O2中 B、 SO3, SO2中 C、 SO3, SO2 ,O2中 D 、SO2, O2中
2,对于反应N2 +3H2 2NH3,该反应放热,下列不是该反应达到平衡状态的标志是
2NH3,该反应放热,下列不是该反应达到平衡状态的标志是
A生成氨的速率与分解氨的速率相等 B断开一个N≡N,同时有六个N-H键生成
C N2 、H2,、NH3的质量分数不再变化 D混合气体总压不再改变
3,在一定温度下,可逆反应A2(g)+B2(g)  2AB(g) 达到平衡状态的标志是 ( )
2AB(g) 达到平衡状态的标志是 ( )
A容器中总压强不随时间变化 B单位时间内消耗1molA2同时消耗1molB
C单位时间内生成2molA B同时消耗1mol A2 D单位时间内分解2molA B同时消耗1mol A2
4,可逆反应2SO2+O2 2SO3 正反应速率分别用v(SO2)、v(O2)、v(SO3) [单位:mol·(L·min)-1]
表示 ,逆反应速率分别用 v’(SO2)、v’(O2)、v’(SO3)表示,当化学平衡时正确的关系是
( )
2SO3 正反应速率分别用v(SO2)、v(O2)、v(SO3) [单位:mol·(L·min)-1]
表示 ,逆反应速率分别用 v’(SO2)、v’(O2)、v’(SO3)表示,当化学平衡时正确的关系是
( )
A v(O2)= v’`(SO2),=v(SO3) B v’(SO2) =v(SO3)
C v(O2)= 1/2v’(O2) D v’(SO2)=v’(O2)=v’(SO3)
 5,在一定温度下, 硫酸铜晶体在饱和水溶液中有如下平衡: CuSO4+ X H2O
5,在一定温度下, 硫酸铜晶体在饱和水溶液中有如下平衡: CuSO4+ X H2O CuSO4.X H2O 当溶液中加入少量无水硫酸铜时,下列说法正确的是 ( )
CuSO4.X H2O 当溶液中加入少量无水硫酸铜时,下列说法正确的是 ( )
A溶液中铜离子浓度增大 B溶液中铜离子浓度减小C硫酸铜晶体变大D溶液颜色变浅
6,保持相同温度时,可逆反应2A(g)+B(s)
 2C(g)
在1×105Pa达到平衡时和
在1x106Pa达到平衡时,其逆反应速率
( )
2C(g)
在1×105Pa达到平衡时和
在1x106Pa达到平衡时,其逆反应速率
( )
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.不能肯定
7, 说明可逆反应A(g)+B(g)  C(g)+D(g)在一定条件下已达到平衡的事实是 ( )
C(g)+D(g)在一定条件下已达到平衡的事实是 ( )
A、容器中总压强不随时间变化 B、容器内A,B,C,D四者共存
C、 A D消耗速率相等 D、D C生成速率相等
8,下图的曲线是800℃时,A、B、C三种气体物质的浓度随时间变化情况, T是平衡的时间,能以此曲线表示的反应是 ( )
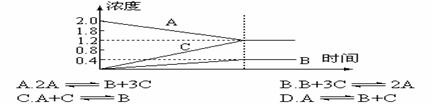
9,压强变化不会使下列化学平衡发生改变的是 ( )
A H2(g)
+ I2(g)  2HI(g)
B N2(g)
+ 3H2(g)
2HI(g)
B N2(g)
+ 3H2(g)  2NH3(g)
C 2SO2(g)
+ O2(g)
2NH3(g)
C 2SO2(g)
+ O2(g)  2SO3(g) D C(s) + CO2(g)
2SO3(g) D C(s) + CO2(g)
 2CO(g)
2CO(g)
10,下列说法正确的是 ( )
A可逆反应的特征是正反应速率等于逆反应速率
B在其他条件不改变时,增大压强对溶液间反应几乎无影响
C温度升高,可以使可逆反应正反应速率加快,但逆反应速率可以不变
D使用催化剂可以使原来不能发生的反应变为可能发生了
11,在一定温度下,向aL密闭容器中加入1 mol X气体和2 mol Y气体,发生如下反应:
X(g)+2Y(g)  2Z(g)此反应达到平衡的标志是
( )
2Z(g)此反应达到平衡的标志是
( )
A. 容器内X、Y、Z的浓度之比为1:2:2
B. 容器内各物质的浓度不随时间变化
C. 容器内气体总质量不随时间变化
D. 容器内气体密度不随时间变化
12,对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是 ( )
A 加入一种反应物 B 对平衡体系加压 C 升高温度 D 使用催化剂
33.(6分)有一稀硫酸和稀硝酸的混合溶液,取出其中的10mL,加入足量氯化钡溶液,将生成的沉淀滤出洗净,烘干称得质量为9.32g;另取这种溶液10mL与4mol/L的NaOH溶液25mL恰好完全中和;再取10mL原混合溶液与0.96g铜粉共热;
求:(1)稀硫酸的物质的量浓度是多少?
(2)有多少毫升气体产生?(标准状况下)
32.(8分)接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。某硫酸厂每天排放的1万米3(已换算成标准状况)尾气中含0.2%(体积百分数)的SO2。
(1)若用生石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克生石膏?
(2)若用氨水处理,最少需要标况下的氨气多少升?最多需要标准状况下的氨气多少升?
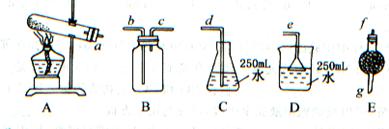
31.取wg含有杂质(杂质受热不分解)的NH4HCO3,选用如图所示的装置,制取一瓶干燥的氨气,多余氨气全部被水吸收。回答:
(1)选用的装置是(用A、B、C……回答) ,连接选取装置的正确顺序是(a,b,c……填写): 接 ; 接 ; 接 。
(2)E装置中所盛药品的名称是 ,其作用是 。
(3)若选用B装置,连接时b口进气还是C口进气 ,其原因是 。
(4)若收集到氨气VmL(标准状况),氨水的浓度为a mol/L,则碳酸氢铵的纯度为
%(设NH4HCO3全部分解)。
30.用一种试剂除去下列各气体中的杂质(括号内为杂质):
(1)CO2(SO2):试剂 ,离子方程式
(2)SO2(HCl):试剂 ,离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com