
题目列表(包括答案和解析)
28.(10分)现有m g某气体,它由双原子分子构成,它的摩尔质量为M g·mol-1。若用nA 代表阿伏加德罗常数的数值,则:(只要求写出结果)
(1)该气体的物质的量为________mol。(2)该气体在标准状况下的体积为_________L。
(3)该气体所含原子总数为_______ 个。
(4)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为___ _。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____ mol/L。
|
用该浓硫酸配制200mL1mol/L的稀硫酸,
用量筒所需量取该浓硫酸的体积是多少mL?
(2)在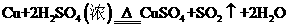 反应中,
反应中,
若有3.2 g的Cu参与反应,则被还原的H2SO4的物质的量是多少?
四校联考高一化学试题答案及评分细则
27.(14分)欲用36.5%(密度为1.18g/cm3)的浓盐酸配制浓度为1.00mol/L的稀盐酸500mL。
(1)选用的主要玻璃仪器有:① ② ③ ④ ⑤ 。
(2)现有下列配制操作,正确的操作顺序为: (填字母)
A.用量筒量取浓盐酸;B.反复颠倒摇匀;C.用胶头滴管加水至刻度线;
D.洗净所用仪器,洗涤液也转入容量瓶;E.稀释浓盐酸;F.溶液冷却后转入容量瓶。
(3)简要回答下列问题:
如果实验室有10mL、50mL、100mL的量筒,应选用 mL的量筒。量取时发现量筒不干净,用水洗净后直接量取,将使配制的溶液浓度 (填“偏高”、“偏低”或“无影响”)。
26.(13分). (1).(3分)现有以下物质①NaCl溶液 ②干冰 ③硫酸 ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦酒精 ⑧熔融状态的KNO3,其中属于电解质的是: ;属于非电解质的是: ;能导电的是: 。(均填序号)
(2).(4分)选择下列实验方法分离物质,将分离方法的字母填在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
①分离粗盐中混有的泥沙______。 ②分离碘和水的混合物______。
③分离水和汽油的混合物______。 ④分离酒精和水的混合物______。
(3).(2分)离子方程式BaCO3+2H+ == CO2↑+H2O+Ba2+中的H+不能代表的物质是_____________(填序号)①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
(4)(4分)取少量Fe(OH)3胶体置于试管中,向试管中滴加一定量稀盐酸,边滴边振荡,可以看到溶液先出现红褐色浑浊,接着红褐色浑浊逐渐变浅,最终又得到黄色的FeCl3溶液,先出现红褐色浑浊的原因: ,又得到黄色的FeCl3溶液的化学方程式为: 。
25.(12分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)人们常用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下左图。下右图为离子反应、氧化还原反应和置换反应三者之间的关系,则表示离子反应、氧化还原反应、置换反应的字母分别是

(2)将NaBr溶液加入AgC1沉淀中,产生AgBr黄色沉淀。从离子反应发生的条件分析,AgCl与AgBr相比较,溶解度较大的是 。
(3)离子方程式是重要的化学用语。下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点。www.反应物从下列物质中选取:Ca(OH)2、Fe、H2O、CO2、H2SO4、HCl、NaOH、Ba(OH)2、CuCl2、
|
|
错误观点 |
“否定的”离子方程式 |
|
① |
所有碱溶液与CO2反应均可以表示为: 2OHˉ+CO2 =H2O+ CO32- |
|
|
② |
所有酸碱中和反应均可表示为: H++OHˉ=H2O |
|
24.(9分)某一反应体系有反应物和生成物五种物质: O2 H2CrO4 Cr(OH)3 H2O H2O2
已知该反应中H2O2只发生如下过程H2O2→O2
(1)该反应中的还原剂是________________________。
(2)该反应中,发生还原反应的过程是_____________→_____________。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为_____________。
23.常温常压下,用等质量的CH4、CO2、O2、SO2 分别吹出四个气球,气球体积依次增大,其中的气体为 CH4 的是( )

第II卷(非选择题,共64分)
22.下列反应中,水作氧化剂,且该反应属于置换反应的是( )
A. H2O+Cl2 =HCl +HClO B.2F2 +2H2O = 4HF + O2↑
C. 2Na + 2H2O = 2NaOH +H2↑
D.2H2O 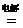 2H2↑ +O2↑
2H2↑ +O2↑
21.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.100mL 0.1mol·L-1的稀硫酸中含有SO42-个数为0.1NA
B. 1 mol大米中含有NA个大米粒子
C. 2.7g金属铝与足量的盐酸反应,铝失去电子数为0.3NA
D. 常温常压下,11.2L甲烷所含的分子数为0.5NA
20.在0.5 L某浓度的Na2SO4溶液中含有0.5 mol Na+,对该溶液的说法不正确的是( )
A.该溶液的物质的量浓度为1 mol·L-1
B.该溶液中含有35.5 g Na2SO4
C.配制100 mL该溶液需用7.1 g Na2SO4
D.量取100 mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1 mol
19.在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO42-、CO32-、OH-六种离子。已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子的是( )
A. Cu2+、H+、SO42- B. Na+、OH-、CO32-
C. CO32-、OH-、SO42- D. Na+、H+、SO42-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com