
题目列表(包括答案和解析)
22、(15分)在实验室常用下面的方法制备氢氧化铁胶体:用洁净的烧杯取少量的蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1mol.L-1FeCl3溶液,至液体呈透明的红褐色。请按要求回答下列问题:w.w.^w.k.&s.5*高.考.资.源.网
(1)反应的化学方程式为 ;(2)氢氧化铁胶体中微粒直径的范围是 m;
(3)判断胶体制备成功的方法是 ;
(4)若向此分散系中逐滴加入盐酸稀溶液,会发生一系列变化:
①先出现红褐色沉淀,原因是 ;
②随后沉淀会溶解,溶液呈黄色,写出此反应的离子方程式 ;
21.(8分)下表是验证饱和氯水中所含主要粒子的实验操作和实验现象,请根据实验要求将相应的操作和现象的标号填在答案栏内。
w.w.^w.k.&s.5*高.考.资.源.网
|
粒子 |
操作 |
现象 |
答案 |
||
|
a.H+ b.Cl- c.Cl2 d.HClO |
①将氯水滴入有机色素品红溶液中 ②在氯水中滴加紫色石蕊试液 ③在氯水中滴加AgNO3溶液 ④将湿润的淀粉碘化钾试纸置于 氯水试剂瓶上方 |
A.有白色沉淀生成 B.试纸有白色变成蓝色 C.品红由红色变成无色 D.滴入瞬间溶液显红色随即又褪去 |
a. |
|
|
|
b. |
|
|
|||
|
c. |
|
|
|||
|
d. |
|
|
20..(6分)在硝酸铅[Pb(NO3)2]的稀溶液中滴入几滴稀硫酸,生成白色PbSO4沉淀,再滴入数滴饱和醋酸钠溶液,微热并不断搅动,沉淀慢慢溶解.以上发生的都是复分解反应,写出反应过程的离子方程式 、 ,试推测第二步离子反应发生的原因是 。
19.(7分)某河道两旁有甲乙两厂。它们排放的工业废水中,共含K+、Ag+、Fe3+、Cl--、OH-、NO3- 六种离子,已知甲厂的废水明显呈碱性。
(1)甲厂废水中所含的三种离子是 。
(2)如果加一定量 (选填:活性炭、铁粉),可以回收其中的金属 (填写金属元素符号)。
(3)将甲厂和乙厂的废水按适当的比例混合,可以使废水中的某些离子转化为沉淀,转化为沉淀的离子分别为 (填写离子符号)。经过滤后的废水主要含 (填化学式),可用来浇灌农田。
18.有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是 ( )
A.K+一定存在 B.100mL溶液中含0.01molCO32-
C.Ba2+一定不存在,Mg2+可能存在 D.Cl-一定存在
第Ⅱ卷(非选择题共46分)
17.标准状况下,某种O2和N2的混合气体m g含有b个分子,则n g该混合气体在相同状况下所占的体积(L)应是 w.w.^w.k.&s.5*高.考.资.源.网 ( )
A. 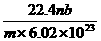 B.
B. 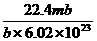
C. 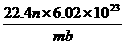 D.
D. 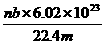
16.将SO2通入CuSO4和NaCl的浓溶液中,溶液颜色变浅,析出白色沉淀,取该沉淀分析,知其中含Cl:35.7%,Cu:64.3%,SO2在上述反应中的作用是 ( )
A. 酸 B. 漂白剂 C. 还原剂 D. 氧化剂
15.标准状况下,将一盛满HCl的试管倒置于水槽中,液体最终充满整个试管,假定溶质不扩散,则试管内盐酸的浓度为 ( )
A.0.045 mol. L -1 B.1.00 mol .L -1
C.0.029 mol. L -1 D.无法确定
14.某物质的组成为CxHyOz,取该物质mg在足量的O2中充分燃烧后,将产物全部通入过量的Na2O2中,若固体Na2O2的质量也增加mg,则该物质分子组成中必须满足( )
A.x=y=z B.x=y C.y=z D.x=z
13.下列电离方程式中,正确的是 ( )
A.NH3.H2O=NH4++OH- B.Na2SO4=2Na++SO4-2
C.Ba(OH)2=Ba2++2OH- D.NaHCO3=Na++H++CO32-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com