
题目列表(包括答案和解析)
6.FeCl3溶液与Fe(OH)3胶体具有共同的性质是
①分散质颗粒直径在1-100nm之间 ②能通过滤纸
③都是透明的 ④呈红褐色
A.①② B.②③ C.③④ D.②④
5.在3Cl2+6KOH= KClO3+5KCl+3H2O的反应中,氧化剂和还原剂的质量比是
A.1:5 B.5:1 C.1:1 D.2:1
4.下列实验中均需要的仪器是
①配制一定物质的量浓度的溶液 ②PH试纸的使用 ③过滤 ④蒸发
A.试管 B.胶头滴管 C.玻璃棒 D.漏斗
3.下列叙述中正确的是
A.含最高价元素的化合物,一定具有强氧化性
B.阳离子只有氧化性,阴离子只有还原性
C.失电子越多,还原性越强
D.强氧化剂与强还原剂不一定能发生氧化还原反应
2.下列状态的物质,既能导电又属于电解质的是
A.NaCl溶液 B. 液态 HCl C. 熔融的KOH D. 蔗糖溶液
1.如果你家里的食用花生油混有水份,你将采用下列何种方法分离
A.过滤 B.蒸馏 C.分液 D.萃取
30、(8分) 密度为1.19g/cm3,质量分数为36.5%的浓盐酸100mL与二氧化锰加热充分反应,生成1.12L氯气(标准状况下)。求:(1)该浓盐酸的物质的量浓度为多少?(2)参加反应的二氧化锰有多少克?(3)被氧化的HCl的物质的量为多少?(4)在反应后溶液中加入足量AgNO3溶液,理论上可得多少AgCl沉淀?(不考虑浓盐酸的挥发)
菱湖中学2010学年第一学期
29、(11分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
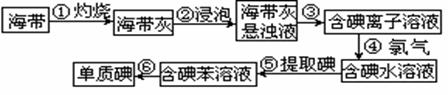
请填写下列空白:
(1) 从上述步骤中可知,海带中含有的碘元素的主要存在形式是 ▲ ;
(2) 步骤④中发生的反应,请分别写出反应的离子方程式: ▲ ;
(3) 检验海带中是否含有碘元素,可以在步骤④后进行,检验时可用的试剂是 ▲ ;
(4) 步骤⑤中,某学生选择用苯来提取碘,其实验操作可分解为如下几步: (A)把盛有溶液的分液漏斗放在铁架台的铁圈中;
(B)把50毫升碘水和15毫升苯加入分液漏斗中,并盖好玻璃塞;
(C)检验分液漏斗活塞和上口的玻璃塞是否漏液;
(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
(E)旋开活塞,用烧杯接收溶液;
(F)将分液漏斗上口倒出上层溶液;
(G)将漏斗上口的玻璃塞打开;
(H)静置,分层;
就此实验,完成下列填空:
①正确操作步骤的顺序是 ▲ → ▲ → ▲ →A→G→H→E→F ②上述(G)步骤操作的目的是 ▲
③能选用苯从碘水中萃取碘的原因是 ▲ 。
28、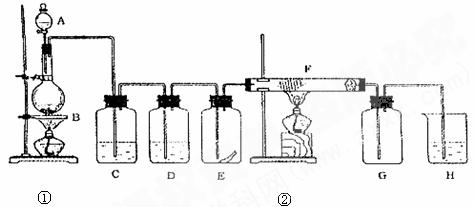 (11分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,右端为一团棉花。
(11分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,右端为一团棉花。
试回答:
(1)烧瓶B中发生的反应的化学方程式为 ▲ ,该反应中的氧化剂是 ▲ ;
(2)C中试剂是 ▲ ;D中试剂的作用是 ▲ ;
(3)E中现象是 ▲ ; F中反应的化学方程式为 ▲ ;
(4)H中试剂为 ▲ ,发生反应的化学方程式为 ▲ ;
27、(5分)现有几种元素的性质或原子结构如下表:
|
元素编号 |
元素性质或原子结构 |
|
T |
失去一个电子后,形成Ne原子电子层结构 |
|
X |
最外层电子数是次外层电子数的2倍 |
|
Y |
其单质之一是空气中主要成分,最常见的助燃剂 |
|
Z |
形成双原子单质分子,黄绿色气体 |
(1)元素X的一种同位素用来作原子量标准,这种同位素的符号是 ▲ 。
(2)写出工业上制取单质Z的化学方程式 ▲ 。
(3)画出T的原子结构示意图 ▲ ,写出T和Y组成的一种淡黄色化合物的化学式 ▲ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com