
题目列表(包括答案和解析)
1.(2009·苏州高一检测)科学家预测原子序数为114号的元素的原子,具有相当的稳定性,它的位置在第七周期第ⅣA族,称为类铅。关于它的性质,预测错误的是( )
A.它的最外层电子数为4
B.它的金属性比铅强
C.它有7个电子层
D.它的最高价氧化物对应的水化物是强酸
[解析]选D。由题意知114号元素在第ⅣA族中铅的下面,所以它最外层有4个电子,有7个电子层,金属性比铅强,最高价氧化物对应水化物应显碱性,A、B、C正确,D错误。
8.(12分)为维护社会秩序,保障公共安全,确保北京奥运会及残奥会的顺利进行,北京市人民政府对257种化学品实施了管制,化学品氮化钠就是其中的一种,氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是_____ ,该化合物由_____键形成。
(2)Na3N与盐酸反应生成_____种盐,其电子式分别是_____ 。
(3)Na3N与水的反应属于_____反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r (Na+) _____
r(N3-)(填“>”、“=”或“<”)。
[解析]Na3N为离子化合物,与水反应符合水解规律,实际上也是复分解反应,Na+ 与N3- 属电子层结构相同的粒子,钠的核电荷数大于氮的核电荷数,故r(Na+)<r (N3-)。
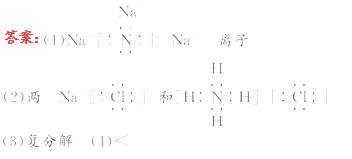
7.(12分)A、B、C、D、E、F是原子序数依次增大的同周期元素,已知A、C、F的原子最外层电子数之和为11,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的次外层电子数比最外层电子数多4个,E元素原子最外层与最内层电子数的差是3,试回答:
(1)写出下列元素的元素符号:A _____ ,C _____ ,D _____ ,E _____ 。
(2)用电子式表示B和F形成化合物的过程:_____。
(3)写出A、C、F三种元素最高价氧化物的水化物相互反应的化学方程式_____ , _____, _____。
[解析]A、C、F三种元素的最高价氧化物的水化物之间两两皆能反应,说明一定有铝、钠。三元素的原子最外层电子数之和为11,故F为氯,A为Na,C为铝,D的次外层电子数比最外层电子数多4个,说明其次外层电子数为8,故D为Si,E的最内层电子数为2,最外层电子数为5,故E为P。
答案:(1)Na Al Si P
(2) 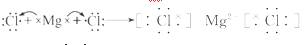
(3)NaOH+Al(OH)3====NaAlO2+2H2O
NaOH+HClO4====NaClO4+H2O
Al(OH)3+3HClO4====Al(ClO4)3+3H2O
[实验·探究]
6.(6分)A、B、C、D四种短周期元素,它们的原子序数依次增大,其中A与C及B与D分别是同主族元素;已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16;又知A、C两元素原子序数之和是B、D两元素原子序数之和的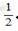 。请回答下列问题:
。请回答下列问题:
(1)写出由A、B、C三元素形成的化合物的电子式___ ,
所含化学键的类型有______ 。
(2)A2B与A2D的沸点:A2B ______ (填“高于”、“低于”)A2D,其原因是______ 。
(3)由A、B、C、D四种元素形成的物质X,与盐酸反应能够生成具有刺激性气味的气体,写出X与盐酸反应的离子方程式________________________。
[解析]已知B、D两元素间可形成DB2和DB3两种化合物,两者相对分子质量相差16,则推出B的相对原子质量为16,所以B为O;又因为B、D同主族,且D的原子序数大于B,所以D为S;B、D原子序数之和的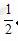 是12,又因为A、C同主族,所以A为H,C为Na。
是12,又因为A、C同主族,所以A为H,C为Na。
答案:(1)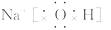 离子键、共价键
离子键、共价键
(2)高于 水分子之间能形成氢键,使水的沸点比H2S的高
(3)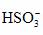 +H+
====SO2↑+H2O
+H+
====SO2↑+H2O
5.(2009·昆明高一检测)下列叙述正确的是()
A.离子键只存在于金属阳离子与酸根阴离子之间
B.两种非金属元素形成AB型化合物,它一定含共价键
C.物质中化学键破坏了,一定发生化学变化
D.化学键类型由元素类别决定
[解析]选B。氧化钠、氯化铵等都含有离子键,A项错误;非金属原子之间形成的化学键一定是共价键,注意氯化铵之间的离子键属于铵根离子与氯离子之间的作用力,不属于原子之间的作用力,B项正确;物质中有旧化学键断裂,同时有新化学键形成的变化是化学变化,如氯化钠熔化、氢氧化钠溶于水等都不是化学变化,C项错误;离子化合物不一定含金属元素,如铵盐,含金属元素的化合物不一定是离子化合物,如氯化铝、氯化铁等,D项错误。
3.现有如下各种说法:
①在水中氢、氧原子间均以化学键相结合;
②金属元素和非金属元素化合形成离子键;
③离子键是阳离子、阴离子的相互吸引;
④根据电离方程式HCl====H+ +Cl-,判断HCl分子中存在离子键;
⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确的是( )
A.①②⑤正确 B.都不正确
C.④正确,其他不正确 D.仅①不正确
[解析]选B。水分子内H、O原子之间有相互作用,分子间的H、O原子也相互作用。而化学键只指分子内部相邻原子间强烈的相互作用,故①不正确。离子键不是存在于任何金属元素和非金属元素微粒间,只是活泼金属元素和活泼非金属元素化合时才可形成离子键,故②不正确。在离子化合物中,阴、阳离子间存在相互作用,但不单指吸引力,还有排斥力,故③不正确。HCl分子中不存在离子,它属于共价化合物,分子中没有离子键,故④不正确。化学反应的本质是旧键断裂新键形成,但HCl中存在共价键而非离子键,故⑤不正确。

[解析]选D。A项中从冰到水,从水到水蒸气都是破坏分子间作用力;从水蒸气到H2和O2破坏极性键形成非极性键。B项破坏金属键和非极性键形成离子键;C项破坏非极性键形成极性键;D项中的H2O2的结构式为H-O-O-H,分子中极性键和非极性键被破坏,生成H2O和O2分别形成了极性键和非极性键。
2.共价键、离子键和分子间作用力是物质间的不同作用力,下述物质中只含上述一种作用力的是( )
A.干冰 B.氯化钠 C.氢氧化钠 D.碘
[解析]选B。干冰(CO2)中含共价键和分子间作用力;NaCl中只含离子键;NaOH中含离子键和共价键;I2中含分子间作用力和共价键,故选B。
1.(2009·长春模拟)下列表示物质结构的化学用语或模型图正确的是( )
A.CO2的比例模型: 
B.H2O2的电子式: 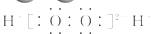
C.HClO的结构式:H-O-Cl
D.14C的原子结构示意图: 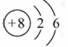
[解析]选C。碳原子的半径比氧原子的大,所以CO2的比
例模型中应该是中间的球比两边的球大,A选项错误;
H2O2是共价化合物, 分子中不存在阴阳离子,正确的电
子式为 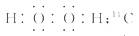 ;14C的质子数为6,其正确的
;14C的质子数为6,其正确的
原子结构示意图为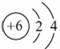 。
。
0.55 mol·L-1烧碱反应能生成0.027 5 mol H2O,而50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1烧碱反应只能生成0.025 mol H2O,因此所放出热量不同。但中和热是指酸与碱发生中和反应生成1 mol H2O时所放出的热量,与酸、碱的用量无关,因此所求中和热相等 (5)2.53
7.(16分)如图所示:在800 mL的大烧杯中放入碎纸屑,把盛有50 mL 0.50 mol·L-1盐酸的200 mL烧杯放到大烧杯中,两只烧杯间填满碎纸屑。用泡沫塑料板做成大烧杯盖,通过盖子插入一根玻璃搅拌器(末端呈半圆环的玻璃棒)和一只温度计,测定溶液的温度。迅速往盐酸溶液中加入50 mL 0.55 mol·L- 1烧碱溶液,盖好,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
1烧碱溶液,盖好,搅拌溶液,观察温度的变化。当温度保持稳定时,记录读数,取出装反应液的烧杯,倒出溶液,清洗干净,保持内外杯壁干燥。重复进行三次实验。用这一实验可以粗略测定中和热。
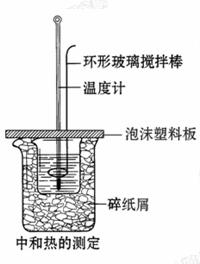
(1)烧杯间填满碎纸屑的作用是_____ 。
(2)要重复进行三次实验的目的是_____ 。
(3)烧杯如不盖硬纸板,求得的中和热数值将_____ (填“偏大”、“偏小”或“无影响”)。
(4)实验中若改用60 mL 0.50 mol·L-1盐酸和50 mL 0.55 mol·L-1烧碱溶液进行上述反应,与上述实验相比,所放出的热量_____
(填“相等”或“不相等”),所求中和热_____ (填“相等”或“不相等”),理由是_____ 。
。
(5)三次平行操作测得数据中,起始时盐酸与烧碱溶液温度相同,而终止温度与起始温度之差(t2-t1)分别为
①2.3 ℃ ②2.4 ℃ ③2.9 ℃,则最终代入计算式的温度差的平均值为_____ ℃。
[解析]测定中和热的实验是一个定量实验,分析实验装置和操作时要注意两个方面:一是“量”的问题,二是尽量减少实验误差。
答案:(1)保温、隔热、减少实验过程中放出热量的损失
(2)减少实验过程中的误差 (3)偏小 (4)不相等 相等 因为60 mL 0.50 mol·L-1盐酸和50 mL
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com