
题目列表(包括答案和解析)
33.(12分)已知:①A、B、C、D四种物质均含有元素X,可能还含有元素Y或Z。元素Y、X、Z的原子序数依次递增且不超过20。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D在二氧化锰催化下受热分解,可制得元素Y的单质。请回答下列问题:
(1)写出B、C、D的化学式:B __ ,C ,D 。
(2)用电子式表示C的形成过程 。
32.(10分)某无色溶液中含有K+、Cl-、OH-、SO、SO,为检验溶液中所含的各种阴离子,限用的试剂有:盐酸、硝酸、硝酸银溶液、硝酸钡溶液、溴水和酚酞试液。检验其中OH-的实验方法从略,检验其他阴离子的过程如下图所示。
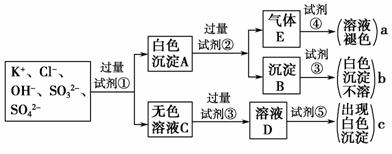
(1)图中试剂②-④溶质的化学式分别是:②_________,③_________,④_________,
(2)图中现象a、c表明检验出的离子分别是:a________、c_________。 www.k@s@5@ 高#考#资#源#网
31.(10分)按下列要求回答:现有①BaCl2;②金刚石;③NH4Cl;④Na2SO4;⑤干冰;⑥碘
(1)熔化时不需要破坏化学键的是__________(填序号,下同),熔点最低的是__________。
(2)属于离子化合物的是__________
(3)①的电子式是________________,⑤的电子式是________________。
30.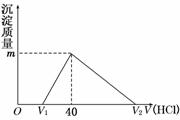 将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL OH-浓度为1mol/L的溶液,以及一定量的H2;然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是 ( )
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL OH-浓度为1mol/L的溶液,以及一定量的H2;然后用1 mol/L的盐酸滴定,沉淀质量与消耗盐酸的体积关系如图所示,则下列选项正确的是 ( )
A.图中m值为1.56 g
B.标准状况下产生氢气896 mL
C.原合金质量为0.92 g D.图中V2为60 mL
29.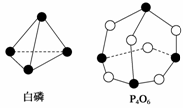 化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O===O:498,则反应P4(白磷)+3O2===P4O6,0.5mol P4的完全反应时吸放热为( )
化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷和P4O6的分子结构如下图所示,现提供以下化学键的键能(kJ/mol):P-P:198,P-O:360,O===O:498,则反应P4(白磷)+3O2===P4O6,0.5mol P4的完全反应时吸放热为( )
A.放热1 638 kJ B.吸热1 638 kJ
C.放热819 kJ D.吸热126 kJ
28.稀土是工业味精,邓小平说过“中东有石油,我们有稀土”。稀土元素铈(Ce)主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应。已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+。下列说法正确的是( )
A.已知Ce原子序数是58,则其为镧系元素
B.铈有四种稳定的核素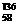 Ce、
Ce、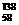 8Ce、
8Ce、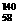 Ce、
Ce、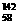 Ce,它们互为同位素
Ce,它们互为同位素
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
27. 几种短周期元素的原子半径及主要化合价见下表:
|
元素符号 |
X |
Y |
Z |
R |
T |
|
原子半径(nm) |
0.160 |
0.111 |
0.104 |
0.143 |
0.066 |
|
主要化合价 |
+2 |
+2 |
-2,+4,+6 |
+3 |
-2 |
根据表中信息,判断以下说法正确的是( ) A.单质与稀硫酸反应的速率快慢:R>Y>X
B.离子半径:T2->X2+ C.元素最高价氧化物对应的水化物的碱性:Y > R >X
D.形成氢化物的沸点:T>Z
26. 下列指定微粒的个数比为2:1的是( )
A. Be2+离子中的质子和电子 B. 21H原子中的中子和质子
C. NaHCO3晶体中的阳离子和阴离子 D. BaO2(过氧化钡)固体中的阴离子和阳离子
25. 右图是元素周期表中短周期的一部分,X、Y、Z、W四种元素的原子核外最外层电子数之和等于Y、Z元素的原子序数之和。下列说法不正确的是( )
|
B.Z与Y元素形成的化合物熔点很高
C.已知W单质分子间作用力较大,则其加压时易液化
D.Z的最高价氧化物能溶于X的最高价氧化物的水化物中
24. 下列说法正确的是( )
A.原子最外层电子数等于或大于3(小于8)的元素一定是主族元素
B.原子最外层只有1个电子的元素一定是金属元素
C.最外层电子数比次外层电子数多的主族元素一定位于第二周期
D.元素的主族序数m与周期数n之比m:n=1,该元素一定是金属元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com