
题目列表(包括答案和解析)
31、已知甲、乙、丙是三种常见的单质,且组成它们的元素核电荷数之和为35;A-G是七种常见化合物,上述各物质间的相互转化 关系如下图所示(反应条件和其它生成物略)。
关系如下图所示(反应条件和其它生成物略)。
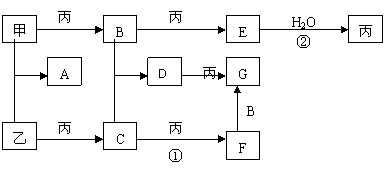
试回答:
(1)B的化学式是:______ ,D的名称是_________ ;
(2) 写出①、②两步变化的化学方程式: ; 。[来
30、储氢纳米碳管的研究成功体现了科技的进步,但用电孤法合成的碳纳米管常伴有大量的
杂质--碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:
 C +
C +  K2Cr2O7 +
K2Cr2O7 +  H2SO4 --
H2SO4 -- CO2
+
CO2
+  K2SO4 +
K2SO4 +  Cr2(SO4)3 +
Cr2(SO4)3 +  H2O
H2O
(1)请配平上述方程式
(2)上述反应中氧化剂是______ _(填化学式) 被氧化的元素是____ __(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是____________(填选项编号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为____ L
29、现有A、B、C、D四种元素,它们的核电荷数依次增大。①A的核电荷数小于10,可形成气态氢化物,该物质在常温下为液体。②A和B两种元素可形成化合物B2A3,该化合物既能溶于强酸,又能溶于强碱。③C的+1价离子C+比B3+离子多8个电子。④C和D可形成化合物CD。⑤CD溶液中通入Cl2后,加淀粉变蓝色。
⑴这四种元素的元素符号为A: B: C: D:
⑵B2A3分别与H2SO4、NaOH溶液反应的离子方程式: ; 。
⑶C的单质与A的氢化物能不能反应?若能反应,写出化学方程式:
⑷写出CD化合物与Cl2反应的离子方程式
28、有下列四种微粒:①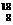 O ②
O ②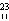 Na ③
Na ③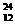 Mg ④
Mg ④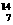 N
N
(1)按原子半径由大到小顺序排列的是__________________________
(2)微粒中质子数小于中子数的是______________________________
(3)在化合物中呈现的化合价的数值最多的是____________________
(4)能形成X2Y2型化合物的是___________,能形成X3Y2型化合物的是___ ________。
________。
27、含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是____________(填离子符号,下同)
(2)加入过量NaOH溶液无沉淀的是_____________
(3)加铁粉溶液质量增重的是_________,溶液质量减轻的___________
(4)遇KSCN溶液呈红色的是_________________________
(5)能用来鉴别Cl–存在的离子是___________
26、原子核外M层上比L层上少2个电子的原子,其元素符号是 ,原子结构示意图是 , 核外有2个电子层、带2个单位负电荷的微粒,其结构示意图是 ,微粒符号是 。
25.现有等体积混合而成的四组气体:①NO2+NO;②NO2+O2;③HCl+N2;④NO+N2,将其分别通入体积相同的试管,并立即倒立于水槽中,试管内水面上升的高度分别为H1,H2,H3,H4,其 中高度
中高度 关系是
关系是
A.H2>H3>H1>H4  B.H3>H2>H1>H4 C.H1=H2=H3=H4
D.H1>H2>H3>H4
B.H3>H2>H1>H4 C.H1=H2=H3=H4
D.H1>H2>H3>H4
24.下列反应既表现硝酸的酸性,又显示硝酸的氧化性的是
A. CuO+2HNO3=Cu(NO3)2+H2O B. FeO+4HNO3=Fe(NO3)3+2H2O+NO2↑
C. C+4HNO3=CO2↑+2H2O+4NO2↑ D. NH3+HNO3=NH4NO3
23. 下列物质属于电解质的一组是
A. CO2、NH3、HCl B. H2SO4、HNO3、BaCl2
C. H3PO4、H2O、Cu D. 液态KNO3、NaOH溶液、C2H5OH
22.赤铜矿的主要成分是Cu2O,辉铜矿的主要成分是Cu2S,将赤铜矿与辉铜矿混合加热发生以下反应:Cu2S+2Cu2O=6Cu+SO2↑,关于该反应的说法中,正确的是
A.该反应的氧化剂只有Cu2O B.Cu2S在反应中既是氧化剂,又是还原剂
C.氧化产物与还原产物物质的量之比为6 : 1 D.每生成19.2 g Cu,反应中转移0.6 mol电
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com