
题目列表(包括答案和解析)
13.元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是
A. XY2 B. X3Y2 C. X2Y3 D. X2Y
12. 从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”,下列既有旧化学键的断裂,又有新化学键的形成的变化是
A.酒精溶解于水 B.使石墨转变为金刚石
C.氯化钠受热熔化 D.冰雪融化为水
11.钛(Ti)金属被称为未来金属,会成为21世纪的主要材料。钛元素的同位素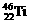 、
、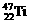 、
、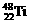 、
、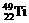 、
、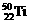 中,中子数不可能的为( )
中,中子数不可能的为( )
A.26 B.28 C.30 D.24
10.既有离子键,又有共价键的化合物是
A.CO2 B.MgCl2 C.H2O2 D.NaOH
9.若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如下图所示的转化关系,则满足条件的甲和丙可以为 K^S*5U.C#O%
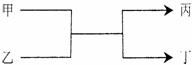 A.钠和氧气
B.硫和氧气
A.钠和氧气
B.硫和氧气
C.碳和硅 D.氯气和溴
8.下列元素中不属于主族元素的是( )
A.磷 B.铁 C.碳 D.氧
7.下列关于铷(Rb)的叙述正确的是
A. 它位于周期表的第四周期、第ⅠA族 B. 氢氧化铷是弱碱
C. 在钠、钾、铷3种单质中,铷的熔点最高 D. 硝酸铷是离子化合物
6.随着卤素原子半径的增大,下列递变规律正确的是……( )
A.单质的熔、沸点逐渐降低 B.卤素离子的还原性逐渐增强
C.气态氢化物稳定性逐渐增强 D.单质氧化性逐渐增强
5.下列关于物质性质变化的比较,不正确的是
A.?酸性强弱:HIO4>HBrO4>HClO4 B.?原子半径大小:Na>S>O
C.?碱性强弱:KOH>NaOH>LiOH D.金属性强弱:Na>Mg>Al
4.元素性质呈周期性变化的本质原因是
A.元素的化合价呈周期性变化 B.元素的核外电子排布呈周期性变化
C.元素的核电荷数逐渐增大 D.元素的相对原子质量逐渐增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com