
题目列表(包括答案和解析)
17.下列关于化学键的说法正确的是
①含有金属元素的化合物一定是离子化合物
②第IA族和第VIIA族原子化合时,一定生成离子键
③由非金属元素形成的化合物一定不是离子化合物
④活泼金属与非金属化合时,能形成离子键
⑤含有离子键的化合物一定是离子化合物
⑥离子化合物中可能同时含有离子键和共价键
A. ①②⑤ B. ④⑤⑥ C. ①③④ D. ②③⑤
16.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀H2SO4溶液中,A极为负极;②C、D用导线相连后,同时浸入稀H2SO4溶液中,电流由D经导线流向C;③A、C相连后,同时浸入稀H2SO4溶液中,C极产生大量气泡;④B、D相连后,同时浸入稀H2SO4溶液中,D极发生氧化反应。据此,判断四种金属的活动性顺序是
A.A>B>C>D B.A>C>D>B C.C>A>B>D D.B>D>C>A
15.下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
14. 氢气在氯气中燃烧时产生苍白色火焰。在反应过程中, 破坏1 mol 氢气中的化学键消耗的能量为Q1 kJ, 破坏1 mol 氯气中的化学键消耗的能量为Q2 kJ, 形成1 mol 氯化氢中的化学键释放的能量为Q3 kJ。下列关系式中, 正确的是
A. Q1+Q2>Q3 B. Q1+Q2>2Q3
C. Q1+Q2<Q3 D. Q1+Q2<2Q3
13.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同电子层结构,下列关系正确的是
A.质子数:c>b B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
12.设NA为阿伏加德罗常数的数值。下列说法错误的是
A.1mol NH3中含有3NA个N-H键
B.在铜与硫的反应中,1 mol铜失去的电子数为2NA
C.标准状况下,11.2L CO2中含有NA个O原子
|
11.下列判断错误的是
A.酸性: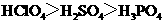
B.碱性: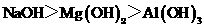
C.沸点:I2>Br2>Cl2>F2
D.沸点:HI>HBr>HCl>HF
10.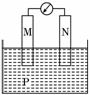 右图所示装置中, 观察到电流计指针偏转,M棒变
右图所示装置中, 观察到电流计指针偏转,M棒变
粗,N棒变细,由此判断下表中所列M、N、P物质,
其中可以成立的是
|
|
M |
N |
P |
|
A |
锌 |
铜 |
稀硫酸溶液 |
|
B |
铜 |
铁 |
稀盐酸 |
|
C |
银 |
锌 |
硝酸银溶液 |
|
D |
锌 |
铁 |
硝酸铁溶液 |
9.下列化合物中, 阴离子半径和阳离子半径之比最大的是
A. LiI B. NaBr C. KCl D. CsF
8.下列含有非极性键的共价化合物是
A. HCl B. Na2O2
C. H2O2 D. CH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com