
题目列表(包括答案和解析)
27.(10分)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“2Fe3+ + Cu = 2Fe2+ + Cu2+ ”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是 ,发生 反应(填“氧化”或“还原”),电解质溶液是 ;
(2)正极的电极反应式 ;
 (3)外电路中,电子是从_______极流出。
(3)外电路中,电子是从_______极流出。
26.(8分)(1)元素S在周期表中的位置是 。
(2)原电池是把 能转变成 能。.
(3)断开1molH-H键需 436kJ的能量(填“吸收”或“放出”)。
24.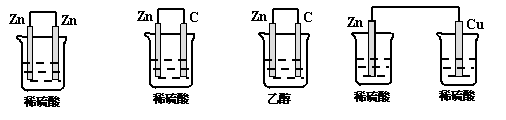 下列各装置中能形成原电池的是
下列各装置中能形成原电池的是
A B C D
25.在2L的密闭容器中发生反应3A + B2C,若最初加入A、B的物质的量都是4mol,10 s后达到平衡,若A的平均速率是0.12mol/(L·s),则平衡后容器中B的物质的量是
A.2.8mol B.1.6mol C.3.2mol D.3.6mol
23.门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,根据元素周期律,下列有关X的描述错误的是
 A.X单质不易与水反应 B.XO2可被碳或氢还原为X
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
 C.X的半径比Si大 D.XH4的稳定性比SiH4的高
C.X的半径比Si大 D.XH4的稳定性比SiH4的高
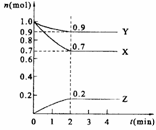
22.X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:
X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为
3:2,则Y的转化率最接近于
A.33% B.40% C.50% D.66%
21.一定温度下,在恒容密闭容器中,能说明可逆反应: H2(g)+
I2(g)  2HI(g)已达到平衡状态的是
2HI(g)已达到平衡状态的是
①单位时间内生成n mol H2的同时生成2n mol HI
②c(H2): c(I2): c(HI) =1:1:2
③v正(H2): v逆(HI) =1:2
④混合气体的密度不再改变的状态
⑤H2的转化率不再改变
⑥混合气体的颜色不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①②③⑥ B.②③⑤⑦ C.①③⑤⑥ D.①④⑤⑦
20.根据以下事实得出的判断一定正确的是
 A.HA的酸性比HB的强,则A的非金属性强于B
A.HA的酸性比HB的强,则A的非金属性强于B
 B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大
 C.同温下A盐的溶解度比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
C.同温下A盐的溶解度比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大
 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强
19.把下列四种X溶液分别加入四个盛有10 mL2 mol/L盐酸溶液的烧杯中,均加入水稀释到50 mL,X和盐酸缓慢地进行反应,其中反应最快的是
 A.10℃ 20 mL 3mol/L的X溶液
A.10℃ 20 mL 3mol/L的X溶液 B.20℃ 30 mL 2mol/L的X溶液
B.20℃ 30 mL 2mol/L的X溶液
 C.20℃ 10 mL 4mol/L的X溶液
C.20℃ 10 mL 4mol/L的X溶液 D.10℃ 20 mL 2mol/L的X溶液
D.10℃ 20 mL 2mol/L的X溶液
18. 某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,
原子核外的电子数为63。下列叙述中错误的是
A.它是副族元素 B.它是第六周期元素
C.它的原子核内有63个质子 D.它的一种同位素的核内有89个中子
17.已知25℃、101kPa条件下:4Al (s) + 3O2 (g) == 2Al2O3 (s) 放出2834.9 kJ热量,
4Al (s) +2O3 (g) == 2Al2O3 (s) 放出3119.91 kJ热量。由此得出的结论正确的是 A.等质量的O2比O3能量低,由O2变O3 为吸热反应 B.等质量的O2比O3能量低,由O2变O3 为放热反应 C.O3比O2稳定,由O2变O3 为吸热反应 D.O2比O3稳定,由O2变O3 为放热反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com