
题目列表(包括答案和解析)
20.铁溶于一定浓度的硝酸时,发生反应的离子方程式为
aFe+ bNO3-+ cH+ == dFe2++ fFe3++ gNO↑+ hNO2↑+ kH20,
下列有关推断中,不正确的是
A.2d+3f=3g+h B.C+b=2d+3f
C.HNO3的氧化性强于Fe3+ D.反应中每消耗5.6gFe,转移0.2mol-0.3mol e-
19.将SO2通入略显酸性的Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时若滴入BaCl2溶液,则会产生白色沉淀,在上述一系列变化过程中,最终被还原的微粒是
A.NO3- B.SO2 C.Fe2+ D.Fe3+
18.下图是元素周期表中短周期的一部分,B、C、D、F四种元素的原子核外最外层电子数之和等于C、D元素的原子序数之和。下列说法不正确的是
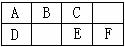 A.B元素形成的气态氢化物分子的空间结构是三角锥形
A.B元素形成的气态氢化物分子的空间结构是三角锥形
B.气态氢化物的稳定性C>E的原因是C分子间存在氢键
C.EF2分子中各原子的最外层均满足8电子稳定结构
D.A的单质均能溶于热的B或E的最高价氧化物的水化物的浓溶液中
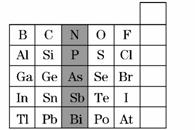
17.右图是元素周期表的一部分,下列说法正确的是
A.阴影部分元素在周期表中处于第ⅣA族
B.H3AsO4的酸性大于H3PO4
C.根据NaH的存在,也可把氢元素放在第ⅦA族
D.向硅酸钠溶液中加入盐酸可证明氯的非金属性强于硅
16.锌与很稀的硝酸反应生成硝酸锌、硝酸铵和水。当生成1 mol硝酸锌时,被还原的硝酸的物质的量为
 A.0.25mol B.1
mol C.0.5mol D.2mol
A.0.25mol B.1
mol C.0.5mol D.2mol
15.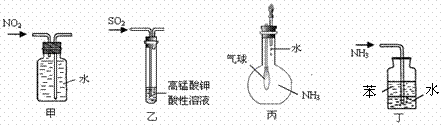 用下列实验装置进行的实验,能达到相应实验目的的是
用下列实验装置进行的实验,能达到相应实验目的的是
A.装置甲:收集NO2气体 B.装置乙:验证SO2气体是否具有漂白性
C.装置丙:验证氨气在水中的溶解性 D.装置丁:用于吸收尾气NH3
14.下列反应的离子方程式正确的是
A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-== BaSO4↓+H2O
B.碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3- + OH- == CO32- + H2O
C.氯化铝溶液中滴加过量氨水:Al3+ + 3NH3·H2O== Al(OH)3↓+ 3NH4+
D.常温下,将铜片加入稀硝酸中:Cu + 2H+ == Cu2+ + 2H2↑
13.对于下列事实的解释错误的是
A.在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性
B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定
C.氮元素是活泼的非金属元素,因此氮气的化学性质也很活泼
D.氨水可使酚酞试剂变为红色,说明氨溶解于水显碱性
12.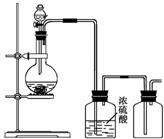 可用右图所示装置制取(必要时可加热)、净化、收集的
可用右图所示装置制取(必要时可加热)、净化、收集的
气体是
A.铜与稀硝酸反应制一氧化氮
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.亚硫酸钠固体与硫酸反应制二氧化硫
11.已知下列元素的半径为:
|
原子 |
N |
S |
O |
Si |
|
半径r/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径可能是
A.1.10 ×10-10m B.0.80×10-10m C.1.20×10-10m D.0.70×10-10m
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com