
题目列表(包括答案和解析)
2.计算1mol不同固态物质和液态物质的体积(见下表)
|
物质 |
1 mol该物质的质量 |
密度 |
1 mol的物质所具有的体积 |
|
Fe |
56g |
7.8g/cm3(20℃) |
7.2cm3 |
|
Al |
27g |
2.7g/cm3(20℃) |
10cm3 |
|
Pb |
207g |
11.3g/cm3(20℃) |
18.3cm3 |
|
H2O |
18g |
1g/cm3(4℃) |
18cm3 |
|
H2SO4 |
98g |
1.83g/cm3(20℃) |
53.6cm3 |
1.物质的体积、密度和质量之间的关系
物质的质量跟它的体积的比叫做这种物质的密度,即物质在单位体积中所含的质量,叫做该物质的密度.
3.通过气体摩尔体积和有关计算的学习,培养分析、推理、归纳、总结的能力.
本节重点:气体摩尔体积的概念和有关气体摩尔体积的计算.
本节难点:气体摩尔体积的概念及其推论的应用.
教材解读 精华要义
2.掌握有关气体摩尔体积的计算.
1.在了解气体的体积与温度和压强有密切关系的基础上,理解气体摩尔体积的概念.
8.现有A、B、C三种化合物,各取40g混合后完全反应,得18g B、49 gC,还有D生成.已知D的式量为106.现将22 g A和11 g B反应,生成D的物质的量为 ( )
A.1 mol B.0.5 mol C.0.275mol D.0.25 mol
答案: D[提示:由题意知A、B、C参加反应的质量关系为:
A + B → C + D
40g 40g-18g 49g-40g
由质量守恒可知,生成D的质量为:40g+(40 g-18 g)-(49 g-40g)=53g.若将22gA与11 gB反应则A有剩余,B充分反应,设反应生成D的质量为x,则有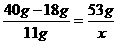 ,得x=26.5 g.
,得x=26.5 g.
因D的式量为106,故D的摩尔质量为106 g/mol,所以D的物质的量为: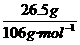 =0.25mol]
=0.25mol]
7.2.16 gX205中含有0.1 mol氧原子,则X的相对原子质量为 ( )
A.2.16 B.28 C.14 D.31
答案:C[提示:因1个X2O5中含5个氧原子,故含0.1 mol氧原子的X2O5的物质的量为0.1 mol×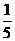 =0.02mol,所以X2O5的摩尔质量为
=0.02mol,所以X2O5的摩尔质量为
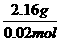 =108g/mol,X的相对原子质量为(108-5×16)×
=108g/mol,X的相对原子质量为(108-5×16)×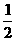 =14]
=14]
6.下列说法中,正确的是 ( )
A.1 mol任何物质都含有阿伏加德罗常数个分子
B.等质量的CO与N2中所含的原子数、分子数均相等
C.磷酸与硫酸的摩尔质量相等,均为98g
D.含氧元素质量相等的SO2与SO3中,含分子数也相等
答案:B[提示:因物质的构成微粒不一定全都是分子,故A项不对;摩尔质量的单位是g/mol,故C项不对;含氧元素相等的SO2与SO3的物质的量不相等,故D项不对;CO与N2的相对分子质量相等,即摩尔质量相等,所以质量相等的CO与N2 的物质的量相等,即所含分子数相等,由于它们均是双原子分子,故所含原子数也相等]
5.下列有关阿伏加德罗‘常数NA的说法中,正确的是 ( )
A. 7.1 g氯气变为氯离子时,得到的电子数为0.2NA
B.2.0g重水(D2O)中所含的电子数为0.1NA
C.28g氮气和28g一氧化碳中所含的原子数都是2NA
D.2.3 g金属钠变为钠离子时失去0.1NA个电子
答案:CD[提示:7.1 g Cl2变为Cl-应得到0.2NA个电子;因D2O的摩尔质量为 20 g/mol,故2.0 g D2O的物质的量为0.1 mol,所含电子数应为0.1 mol×10= 1 mol;28gN2和28 gCO均为双原子分子,且摩尔质量均为28g/mol,故其物质的量均为1 mol,原子数均为2NA;2.3 g Na的物质的量为0.1 mol,故只能失去0.1 NA个电子.C、D两项正确.本题由于审题有误或知识掌握不准而易错选A、B或漏选]
4.把1.15 g钠放入水中,要使100个水分子中溶有1个钠离子,则需要水的质量是 ( )
A.115 g B.100 g C.90.9 g D.90 g
答案:C[提示:1.15 g钠在水中可生成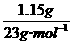 =0.05 mol Na+,同时会消耗 0.05
mol水,而要使溶液中每100个水分子中溶有1个Na+,则需要最后溶液中 剩余0.05×100mol=5mol水,故共需要水5.05mol,质量为90.9g,选C.本题因审题有误而易错选B或D]
=0.05 mol Na+,同时会消耗 0.05
mol水,而要使溶液中每100个水分子中溶有1个Na+,则需要最后溶液中 剩余0.05×100mol=5mol水,故共需要水5.05mol,质量为90.9g,选C.本题因审题有误而易错选B或D]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com