
题目列表(包括答案和解析)
31.(10分)在一支试管中放入几小块镁片,把试管放入盛有25℃的饱和石灰水的烧杯中,用胶头滴管滴5ml盐酸于试管中。试回答下列问题:
(提示:Ca(OH)2的溶解度受随温度的升高而降低。)
⑴该试验中观察到的现象是 ;
⑵产生上述现象的原因是 ;
(3)写出有关反应的离子方程式 ;
⑷在上述试验结束后,将试管取出。在烧杯中放入一个小烧杯,小烧杯中放入氢氧化钡晶体和氯化铵晶体的混合物,用玻璃棒搅拌,则观察到的现象是 ,
产生上述现象的原因是 。
30.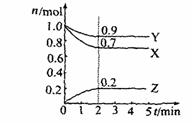 (15分)某温度时,在2L容器中X、Y、Z三种物质的物质的量(n)随着时间(t)变化的曲线如图所示。
(15分)某温度时,在2L容器中X、Y、Z三种物质的物质的量(n)随着时间(t)变化的曲线如图所示。
由图中数据分析:
(1)该反应的化学方程式为 。
(2)反应开始至2min,用Z表示的平均反应速率为 。
(3)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如右图所示:A、B两个电极均由多孔的碳块组成。
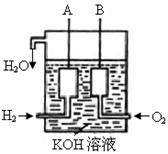 该电池的正极反应式为: ;
该电池的正极反应式为: ;
若该电池工作时增加了1mol H2O,电路中转移电子的物质的量为 。
(4)利用反应“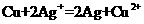 ”设计一个原电池(正极材料用碳棒)。回答下列问题:
”设计一个原电池(正极材料用碳棒)。回答下列问题:
①该电池的负极材料是________,发生________反应(填“氧化”或“还原”),负极的电极反应式为:____________,电解质溶液是________;
②正极上出现的现象是_____________________________;
③若导线上转移电子1 mol,则生成银________g。
29.(14)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置第 周期,第 族;
(2)E元素形成的氧化物对应的水化物的化学式为 ;
(3)元素C、D、E形成的离子半径大小关系是 > > (用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程 ;
C、D还可形成化合物D2C2,D2C2含有的化学键类型是 。
(5)由A、B、C三种元素形成的离子化合物的化学式为 ;它与强碱溶液反应的离子方程式是 。
28.(4分)对于反应:2SO2+O2  2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
|
编号 |
改变的条件 |
化学反应速率 |
|
① |
降低温度 |
|
|
② |
增大O2的浓度 |
|
|
③ |
使用V2O5作催化剂 |
|
|
④ |
压缩体积 |
|
27.(3)在下列物质中:①碘②烧碱③NaCl④干冰⑤氯化氢⑥Na2O2。用序号填写下列空白:
(1)既含有离子键又含有非极性键的化合物是 ;
(2)仅含有离子键的化合物是 ;
(3)仅含有共价键的单质是 。
26.(4分)下列反应属于放热反应的是_ _ ;属于吸热反应的是____ __.
A.锌粒与稀H2SO4反应制取H2 B.氢气在氧气中燃烧
C.碳酸钙高温分解成氧化钙和二氧化碳 D.氢氧化钾和硫酸中和
E.Ba(OH)2·8H2O与NH4Cl反应 F. C与CO2高温生成CO
G.葡萄糖在人体内氧化分解 H.钢铁制品生锈的反应
25. X、Y、Z三种元素的核电荷数在10-20之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A. 元素的得电子能力:X<Y<Z
B.气态氢化物的稳定性:按X、Y、Z顺序变大
C.含氧酸的酸性: H3ZO4>H2YO4>HXO4
D.元素负化合价的绝对值:按X、Y、Z顺序变大
第Ⅱ卷(非选择题 共50分)
24.可逆反应A(g) +3B(g)====2C(g)+2D(g),在四种不同条件下的反应速率如下,其中反应速率最快的是( )
A.VA=0·15mol/(L·min) B.VB=0·6mol/(L·min)
C.VC=0·4mol/(L·min) D.VD=0·6mol/ (L·min)
23.下列关于元素周期表的说法正确的是
A.能生成碱的金属元素都在ⅠA族
B.原子序数为14的元素位于元素周期表的第3周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
22.某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A.HX B.H2X C.XH3 D.XH4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com