
题目列表(包括答案和解析)
25、将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。
(1)NO的体积为多少?
(2)NO2的体积为多少?
大庆中学2010-2011学年下期期中考试
24、回答下列问题。
(1)浓硫酸与木炭在加热条件下反应的化学方程式是_ __________________________
(2)试用下图所列各种装置设计一个实验来验证上述反应所产生的各种产物。
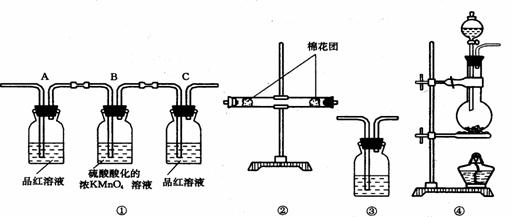
这些装置的连接顺序,按产物气流从左到右的方向是(填装置的编号):
_________→________→________→__________。
(3)实验时可观察到装置①中A瓶的溶液褪色, C瓶的溶液不褪色。
A瓶溶液的作用是________________________________________,
B瓶溶液的作用是______________________________________,
C瓶溶液的作用是__________________________________________。
(4)装置②中所装的固体药品是______________,可验证的产物是____________
(5)装置③中所盛溶液是_______________,可以验证的产物是___________。
23、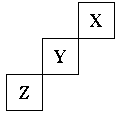 (1)短周期元素X、Y、Z在周期表中位置关系如下图所示。
(1)短周期元素X、Y、Z在周期表中位置关系如下图所示。
①X元素的单质分子式是 若X核内中子数
与质子数相等,X单质的摩尔质量是 。
②Y单质与水反应的化学方程式:
(2)已知下列元素的原子半径:
|
元 素 |
N |
S |
O |
Si |
|
原子半径/10-10m |
0.75 |
1.02 |
0.74 |
1.17 |
根据以上数据,磷原子的半径(10-10m)可能的范围是 。
(3)若X′、Y′是第1周期以外的短周期元素,它们可以形成化合物X′mY′n,且离子均
具有稀有气体原子的电子层结构,则X′、Y′两原子的原子序数a、b的关系可表示
为________________________________
22、A、B、C、D四种元素,A元素所处的周期数,主族序数,原子序数均相等;B的原子半径是其所
在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比
次外层少2个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成
化合物D2C
(1)B元素的名称,________B在周期表中的位置_________________________,
B原子结构示意图__________________;
(2)A、B形成的化合物 的电子式________;
(3)C的元素符号________,C的最高价氧化物的化学式________;
(4)D的阳离子的结构示意图________,D的最高价氧化物的水化物中含有____________键。
(5) 用电子式表示D2C的形成过程:________________________________。
21、盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接
的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8kJ/mol
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H= ―47.2kJ/mol
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________
20、已知金刚石、石墨燃烧的热化学方程式:
C(s 金刚石)+O2(g)=CO2(g) △H1=-395.4kJ/mol
C(s 石墨)+O2(g)=CO2(g) △H2=-393.51kJ/mol
则石墨转化为金刚石的反应热___________,两物质比较,________较为稳定。
19、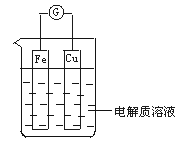 如图所示,组成一个原电池.若电解质溶液为稀硫酸则
如图所示,组成一个原电池.若电解质溶液为稀硫酸则
① Fe电极是__________(填“正”或“负”)极,其电极反应 ___________,
该反应是__________(填“氧化”或“还原”)反应;
② Cu电极是__________电极,其电极反应为____________,
该反应是__________反应..
18、右图是元素周期表的一部分,关于图中阴影部分元素的说法中,正确的是
A.N元素为第一周期元素
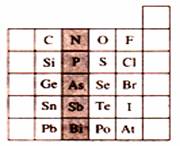
B.PH3的稳定性比H2S强
C.该纵行元素的最高价氧化物对应的水化物化学式均为H3RO4
D.H3AsO4的酸性比H3PO4弱
第II卷(非选择题 共46分)
17、已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H = ― Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H = ―Q2 KJ/mol
2H2(g)+O2(g)==2H2O(1) △H = ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则放出的热量为( )KJ。
A. 0.4Q1+0.05Q3 B. 0.4Q1+0.05Q2 C. 0.4Q1+0.1Q3 D. 0.4Q1+0.1Q2
16、国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号
取消,由左至右改为18列。如碱金属为第1列,稀有气体元素为第18列。按此规定,
下列说法中错误的是
A.第9列元素中没有非金属元素
B.第17列为卤族元素
C.只有第2列元素原子的最外层有2个电子
D.在整个18列元素中,第3列元素种类最多
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com