
题目列表(包括答案和解析)
16.下图是实验室制SO2并验证某些性质的装置图,试回答:
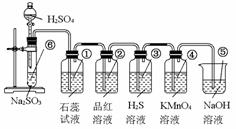
(1)⑥中发生的化学反应方程式为__________________________。
(2)①中实验现象为__________,证明SO2是__________气体。
(3)②中品红溶液(填现象)__________,证明SO2有__________________________。
(4)③中现象是______________,证明SO2有__________性。
(5)④中现象是______________,证明SO2有__________性。
(6)⑤的作用是__________。反应的化学方程式为__________________________。
[答案](1)Na2SO3+H2SO4===Na2SO4+SO2↑+H2O
(2)紫色石蕊试液变红 酸性
(3)褪色 漂白性
(4)溶液变浑浊 氧化
(5)溶液褪色 还原
(6)吸收多余的SO2,防止污染空气
SO2+2NaOH===Na2SO3+H2O
[解析]分液漏斗中的H2SO4滴入试管,可与Na2SO3反应产生SO2,SO2是酸性氧化物,能使石蕊试液变红;SO2具有漂白性,可使品红溶液褪色;SO2具有氧化性,与H2S反应生成单质硫;SO2具有还原性,KMnO4溶液具有强氧化性,故SO2能使紫色高锰酸钾溶液褪色;SO2是有刺激性气味的有毒气体,为避免污染空气,可用碱液吸收。
15.《每周质量报告》曾报道有些不法商贩用硫黄熏蒸银耳、粉丝等食品,可使食品雪白光亮。有些不法商贩使用工业H2O2,使果肉雪白鲜嫩来制果冻。以上硫黄熏蒸利用生成的__________的漂白性,使用工业H2O2利用了H2O2的漂白性,但二者的原理不同,前者是因为__________而使物质漂白,后者则是双氧水(H2O2)的__________性而使物质漂白。
[答案]SO2 SO2与有色物质化合 强氧化
14.近期,世界范围内有成千上万个湖泊变为鱼类绝迹的死湖,数以千万顷计的森林衰败枯萎,大片土地沙漠化……将这些现象与频繁降落的酸雨相联系,人们认为,酸雨是肇事主因。某研究小组研究某地硫酸雨的形成,有人提出以下猜想:
猜想一:氧化雨水
猜想二:雨水氧化
猜想三:以上两过程同时存在
有关上述猜想,收集一定量该地区的刚下的雨水进行实验,下列判断错误的是
( )
A.若猜想一或猜想三正确,该雨水加入盐酸后,再加入BaCl2溶液,有白色沉淀生成
B.若存在猜想二的过程,该雨水可能使品红溶液褪色
C.若存在猜想一的过程,该雨水的pH随时间延长而增大
D.上述任意一个猜想正确,都存在该地区雨水的pH<5.6
[答案]C
[解析]按猜想一,刚下的雨水中就含有H2SO4,滴入盐酸酸化的氯化钡溶液应得到硫酸钡沉淀,而雨水的pH随时间延长应无变化;按猜想二,刚下的雨水中含有H2SO3,能使品红褪色;正常雨水因溶有CO2使pH介于5.6-7,而酸雨的pH小于5.6。
13.下列反应不属于可逆反应的是
( )
A.SO2溶于水和H2SO3分解
B.H2跟O2化合成H2O和H2O分解
C.SO2跟O2化合成SO3和SO3分解
D.NH4Cl受热分解和NH3与HCl化合生成NH4Cl
[答案]BD
[解析]可逆反应是在同一条件下,既能向正反应方向进行同时又能向逆反应方向进行的反应,故B、D不是可逆反应。
12.某气体通入澄清石灰水中先出现浑浊,接着又变澄清,该气体
( )
A.一定是SO2 B.一定是CO2
C.一定不是CO2 D.可能是CO2,也可能是SO2
[答案]D
[解析]CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,SO2+Ca(OH)2===CaSO3↓+H2O,CaSO3+SO2+H2O===Ca(HSO3)2,能使澄清石灰水变浑浊之后又澄清,CO2、SO2均可以。
检验SO2和CO2时不可用澄清石灰水,若为混合气体,应先检验并除去SO2之后再检验CO2。
11.下列反应中,SO2表现氧化性的是
( )
A.2SO2+O2 2SO3
2SO3
B.SO2+H2O===H2SO3
C.2H2S+SO2===3S↓+2H2O
D.SO2+2H2O+Cl2===H2SO4+2HCl
[答案]C
[解析]SO2在反应中表现氧化性,即得电子、化合价降低。A项反应中O2―→O3,硫的化合价升高。B项反应中O2→H2O3,硫的化合价没变。C项反应中O2→,硫的化合价降低。D项反应中O2→H2O4,硫的化合价升高,只有C项符合题目要求。
10.下列溶液通入SO2后最终一定出现沉淀的是
( )
A.盐酸与Ba(NO3)2的混合溶液 B.BaCl2溶液
C.Ca(OH)2溶液 D.氢硫酸
[答案]AD
[解析]在A选项中,因A的混合液里有H+、NO,形成氧化性很强的HNO3,使SO2变成SO,SO与Ba2+反应就生成难溶于强酸的BaSO4白色沉淀,有关反应如下:2HNO3+3SO2+2H2O===3H2SO4+2NO↑,SO+Ba2+===BaSO4↓,其现象为:产生白色沉淀且未消失,即A符合题意。若只有Ba(NO3)2溶液,向其中通入SO2最终也会有沉淀生成,原因是SO2与水反应生成H2SO3,能微弱电离出H+,与NO形成HNO3,HNO3能使SO2变成SO,最终也有BaSO4沉淀生成。对于B选项,二者不反应,故B选项不会产生沉淀。酸性氧化物SO2可与碱液反应:Ca(OH)2+SO2===CaSO3↓+H2O,过量的SO2能与CaSO3继续反应生成Ca(HSO3)2:CaSO3+SO2+H2O===Ca(HSO3)2。故其现象是先有白色沉淀出现,最后白色沉淀消失,即可排除C。SO2中硫显+4价,可与还原剂H2S反应表现其氧化性:SO2+2H2S===3S↓+2H2O。其现象是有沉淀生成且不消失,即D也符合题意。
9.能证明SO2具有漂白性的是
( )
A.酸性KMnO4溶液中通入SO2气体后,紫色消失
B.显红色的酚酞通入SO2后,红色消失
C.品红溶液中通入SO2后,红色消失
D.溴水中通入SO2后,橙色消失
[答案]C
[解析]A选项反应为:5SO2+2KMnO4+2H2O===K2SO4+2MnSO4+2H2SO4,B选项反应为:SO2+2OH-===SO+H2O,D选项反应为:Br2+SO2+2H2O===2HBr+H2SO4。A、D中SO2具有还原性,与氧化性的KMnO4、Br2发生反应而褪色。B选项由于消耗了碱,最终使溶液呈酸性,酚酞指示剂恢复至无色。只有C选项符合,SO2与品红(色素)结合生成无色物质,属于SO2的漂白性。
8.下列物质不能使品红溶液褪色的是
( )
A.SO2 B.Cl2
C.O3 D.CO2
[答案]D
[解析]SO2、HClO(Cl2与H2O作用的产物)、O3均有漂白性,可使品红溶液褪色,CO2不能使品红溶液褪色。此外,Na2O2、活性炭等也可使品红溶液褪色,前者是由于Na2O2的强氧化性使品红溶液褪色,属于化学变化;后者是由于活性炭的吸附性,使品红溶液褪色,属于物理变化。
注意漂白剂的漂白原理,是化学反应还是发生了物理吸附。
7.Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合后再通入品红与BaCl2的混合溶液,能观察到的现象是
( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不会出现沉淀
A.①④ B.①③
C.②③ D.②④
[答案]C
[解析]尽管潮湿的Cl2和SO2都具有漂白作用,但Cl2具有强的氧化性,而SO2具有还原性,若同时使用,它们将会发生如下反应:Cl2+SO2+2H2O===H2SO4+2HCl。这样两种气体等物质的量混合,会完全丧失漂白作用,溶液不会褪色,而生成的H2SO4和BaCl2反应生成不溶于水和酸的白色BaSO4沉淀。
本题最容易发生的错误是忽视了两者的反应,误认为两者混合后漂白作用增强,溶液很快褪色,且溶液不出现白色沉淀。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com