
题目列表(包括答案和解析)
3.下列关于原子的叙述正确的是( )
A 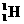 表示氢原子核的质子数是1,中子数也是1。
表示氢原子核的质子数是1,中子数也是1。
B  表示碳的一种同位素原子中含有7个质子和7个中子。
表示碳的一种同位素原子中含有7个质子和7个中子。
C 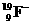 表示该微粒的质量数为19,电子数为9。
表示该微粒的质量数为19,电子数为9。
D 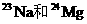 表示两种原子含有相同的中子数。
表示两种原子含有相同的中子数。
2.道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子--分子学说的观点看,你认为不正确的是( )
A 只有① B 只有② C 只有③ D ①②③
1.下列说法中正确的是( )
A 所有的电子在同一区域里运动
B 能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
C 处于最低能量的原子叫基态原子
D 同一原子中,1s、2s、3s所能容纳的电子数越来越多
14.(13分)将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。请回答:
(1)NO的体积为 L,NO2的体积为 L。
(2)待产生的气体全部释放后,向溶液加入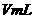
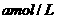 的NaOH溶液,恰好使溶液中的
的NaOH溶液,恰好使溶液中的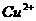 全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
全部转化成沉淀,则原硝酸溶液的浓度为 mol/L。
(3)欲使铜与硝酸反应生成的气体在 溶液中全部转化为
溶液中全部转化为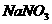 ,至少需要30%的双氧水多少g?(请写出完整的计算过程)
,至少需要30%的双氧水多少g?(请写出完整的计算过程)
13.(12分)下列关系图中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸。当X无论是强酸还是强碱时,都有如下转化关系:
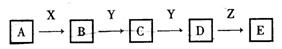
当X是强酸时,A、B、C、D、E均含有同一元素:当X是强碱时,A、B、C、D、E均含有另一种元素。回答下列问题:
(1)写出化学式:A是___________,Y是________,Z是_________。
(2)当X是强碱时,E是____________,当X是强酸时,E是__________。
(3)当X是强碱时,写出A与X反应的离子方程式:
_______________________________________________
12.(15分)如图甲和乙是有关硝酸和铜反应的实验装置示意图,试回答下列问题:
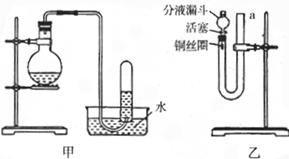
(1)写出制取NO气体时发生反应的离子方程式: 。
(2)某同学用甲装置进行实验,通过排水法收集到无色气体,证明稀HNO3与Cu反应生成的气体是NO,是否可行? ,原因是
。
(3)有人设计了装置乙进行实验,证明稀硝酸与Cu反应生成NO气体。请将下列有关操作补充安全:将活塞打开,从U形管的长管口a注入稀硝酸至 为止,关闭活塞,用酒精灯在 处微热,当U形管左侧产生气泡时,立即撤去酒精灯。
(4)用装置乙进行实验时,一段时间后反应可自动停止,原因是
。
(5)用装置乙进行实验时,如何证明生成的无色气体是NO?
。
11.(8分)碱金属能形成离子型氢化物。如氢化钠的化学式为NaH,氢化钠具有较强的还原性。
(1)氢化钠的电子式为____________,氢化钠中氢元素是______价。
(2)NaH能与水剧烈反应生成对应的碱和氢气,写出反应的化学方程式并标明电子转移的方向和数目_______ ____。该反应中氧化产物与还原产物的质量比为______________。
10.随着人们生活水平的提高,小汽车已进入平常百姓家。为了保护行驶人员的安全,常备有防撞气囊,内装有能在撞车后10ms(1ms=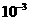 s)内发生爆炸性反应的物质
s)内发生爆炸性反应的物质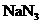 ,化学方程式为
,化学方程式为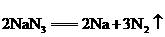 ,驾驶员可在汽车遭撞击后受气囊保护而脱险。此外,气囊内还装有陶土、
,驾驶员可在汽车遭撞击后受气囊保护而脱险。此外,气囊内还装有陶土、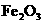 粉等物质,以使气囊内产生的
粉等物质,以使气囊内产生的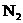 在100ms-200ms内消失,同时气囊内的Na变为
在100ms-200ms内消失,同时气囊内的Na变为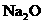 。下列说法中不正确的是 ( )
。下列说法中不正确的是 ( )
A.在1mol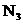 -离子中共含有16mol电子
-离子中共含有16mol电子
B.配方中,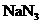 与
与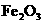 的物质的量之比应在3∶1左右
的物质的量之比应在3∶1左右
C.气囊内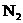 迅速消失的目的是在撞车时不致使人反弹
迅速消失的目的是在撞车时不致使人反弹
D.气囊的保护作用是通过延长作用时间实现的
班级 学号 姓名
9.将2.6g某金属与足量稀硝酸充分反应无气体放出,再向溶液中加入过量NaOH溶液并加热,收集到标况下气体0.224L,该金属是 ( )
A.Zn B.Fe C.A1 D.Mg
8.酸根离子RO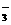 所含电子数比NO
所含电子数比NO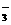 的电子数多10,则下列说法中正确的是 ( )
的电子数多10,则下列说法中正确的是 ( )
A.R原子的电子层数与N原子电子层数相同
B.RO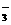 中R的化合价与NO
中R的化合价与NO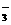 中的N的化合价相同
中的N的化合价相同
C.RO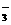 中的R元素既能被还原,也能被氧化
中的R元素既能被还原,也能被氧化
D.R与N为同族元素
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com