
题目列表(包括答案和解析)
1.目前排放到空气中的CO2逐年增加,对此科学家最担心的是( )
A.会使空气中的氧含量下降,不足以供给人类呼吸
B.会使地球温度升高,冰川融化,生态失衡
C.会使人体吸进大量CO2,损害健康
D.会使石灰岩大量溶解,破坏自然风光
关键词: 电离平衡 高中化学 同步课堂
|
化学平衡图象题总汇 |
|||||||||||||||||||||
|
文/张存学 |
|||||||||||||||||||||
图象题是化学平衡中的常见题型,是勒沙特列原理等化学平衡知识在直角坐标系中的直观反映。同时,它又是化学平衡的重点、难点,学生的疑惑点、失分点。怎样解决有关图象问题呢?下面将举例讨论。
一、图象题的一般解题思路
这类题目是讨论自变量x(如时间、温度、压强等)与函数值y(如物质的量、浓度、质量分数、转化率)之间的定量或定性关系,因此,要运用数学方法解决此类题目。
1.分析纵横坐标及曲线表示的意义。
2.分析曲线的变化趋势与纵横坐标的关系。
3.分析特殊点(起点、拐点、终点)及其含义。
4.有两个以上变量时,分别讨论两个变量的关系,此时确定其他量为恒量。
二、图象题的类型
1.物质的量(或浓度)-时间图象
例1.某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图1所示,则该反应的化学方程式为_________,2s内用A的浓度变化和用B的浓度变化表示的平均反应速率分别为_________、_________。
[分析]这类题目是讨论同一时间段内各物质的变化量的比例关系,且要注意物质的量减少的为反应物,物质的量增多的为生成物。又因物质的量都不变时,反应物、生成物共存,故方程式要用“
[分析] 这类题目是讨论速率受外界条件影响而变化的图象。因速率随时间延长先升高后降低,故速率要受反应过程中物质的浓度、温度(或压强)两种因素变化的影响。
[答案]反应是放热反应,温度升高使化学反应速率提高;盐酸物质的量浓度变小使化学反应速率降低。
例3.某温度下,在密闭容器里SO2、O2、SO3三种气态物质建立化学平衡后,改变条件,对反应2SO2+O2
①加催化剂对速率影响的图象是( )。
②升温对速率影响的图象是( )。
③增大反应容器体积对速率影响的图象是( )。
④增大O2的浓度对速率影响的图象是( )。
[分析]这类图象是讨论外界条件对化学平衡的影响。解决这类题目的关键是分析改变条件的瞬间,正、逆反应速率的变化及变化幅度。
[答案]①C
②A ③D ④B
3.速率-压强(或温度)图象
例4.符合图象4的反应为( )。
A.N2O3(g)
[分析]此类图象中曲线的意义是外界条件(如温度、压强等)对正、逆反应速率影响的变化趋势及变化幅度。
答案 B
4.转化率(或质量分数等)-压强、温度图象
例5.有一化学平衡mA(g)+nB(g)
A.正反应吸热,m+n>p+q
B.正反应吸热,m+n<p+q
C.正反应放热,m+n>p+q
D.正反应放热,m+n<p+q
[分析]解决这类图象题目,采用“定一论二”,即把自变量(温度、压强)之一定为恒量,讨论另外两个变量的关系。
答案 A
例6.mA(s)+nB(g)
[分析]这类题目中曲线是表示“平衡”时,质量分数与压强(或温度)变化关系曲线。X、Y点则未达平衡状态,反应要向“趋向于平衡状态方向”进行,以此判断某点v正、v逆的大小关系。比较X、Y两点的速率快慢则依据压强的高低(或温度的高低)。
答案 A、C
例7.图7表示mA(g)+nB(g)
A.m+n>p+q Q>0
B.m+n>p+q Q<0
C.m+n<p+q Q>0
D.m+n<p+q Q<0
[分析]图7中,生成物的质量分数受同种外界条件的影响呈现两种变化趋势,则这两种趋势一定是平衡前、后的两种情况,故最高点时刚好建立平衡,其后,才为外界条件对平衡的影响。
答案 C
5.质量分数-时间图象
例8.对于可逆反应mA(g)+nB(s)
答案
A、C
以上是常见的几种平衡图象及一般解题思路,具体问题要注意综合、灵活地运用。
例9.反应2X(g)+Y(g)
|
27.加热500 g含(NH4)2SO4 13.2%的硫酸铵和碱石灰组成的混合物,并把生成的氨气氧化成NO,再继续氧化成NO2,最后全部转化成HNO3。(反应过程中无损耗)求:
(1) 反应需标准状况下的氧气多少升?
(2) 可制得多少克硝酸?
26.将0.6 mol X气体和0.4 mol Y气体混合于2 L容器中使它们发生如下反应:3X(g)+Y(g) nZ(g)+2W(g),5 min末时已生成02 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
nZ(g)+2W(g),5 min末时已生成02 mol W,若测知以Z浓度变化来表示化学反应速率为0.01 mol /(L·min)。求:
(1) 以X的浓度变化来表示化学反应速率为多少?
(2) 反应中Z气体的化学计量数n的值是多少?
25.下列物质(均为中学化学常见物质)转化关系图中,D为红棕色粉末(反应条件及部分反应物、产物未全部说明)

根据图示转化关系填写下列空白:
(1) 写出下列物质的化学式A ,B ,G 。
(2) C与D的混合物通常称 (填名称)。
(3) 写出下列化学方程式或离子方程式
I+J ® K (离子方程式)。
G+B ® H (化学方程式)。
(4) I的溶液通常显酸性,请用离子方程式解释原因 。
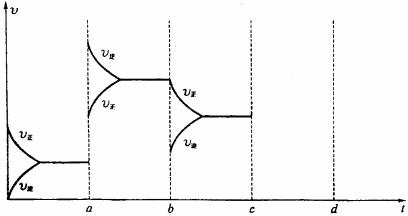
24.下图表示在密闭容器中反应2A+B(g) 2C(g)+Q( Q>0)达到平衡时,由于条件改变而引起的反应速率和化学平衡的变化:a ® b过程改变的条件可能是(填“升温”或“降温”)
,平衡
(填“正向”、“逆向”或“不”)移动,C的体积分数
(填“增大”、“减小 ”或“不变”),b ® c过程中改变的条件可能是
(填“加压”、“降压”、“分离C”或“加入A或B”),c ® d过程中压强变为原来的2倍(缩小体积)、C的浓度变为原来的1.9倍,则平衡
(填“正向”、“逆向”或“不”)移动,说明A一定为
(填“气态”、“液态”、“固态”或“液态或固态”),请将后反应速率变化情况画在c ® d处。
2C(g)+Q( Q>0)达到平衡时,由于条件改变而引起的反应速率和化学平衡的变化:a ® b过程改变的条件可能是(填“升温”或“降温”)
,平衡
(填“正向”、“逆向”或“不”)移动,C的体积分数
(填“增大”、“减小 ”或“不变”),b ® c过程中改变的条件可能是
(填“加压”、“降压”、“分离C”或“加入A或B”),c ® d过程中压强变为原来的2倍(缩小体积)、C的浓度变为原来的1.9倍,则平衡
(填“正向”、“逆向”或“不”)移动,说明A一定为
(填“气态”、“液态”、“固态”或“液态或固态”),请将后反应速率变化情况画在c ® d处。
23.请完成并配平反应
KMnO+ H2S+ H2SO4= K2SO4+ MnSO4+ S↓+
该反应中电子转移总数是 ,当反应中有80 g硫析出时,有 mol还原剂被氧化。
22.实验室常用饱和的NaNO2和NHCl溶液反应制取纯净的氮气用于合成氨气,反应式为NH4Cl+NaNO2 NaCl+2H2O+N2。实验装置如图所示,试回答:
NaCl+2H2O+N2。实验装置如图所示,试回答:
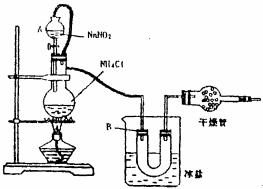 (1) 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用
(填编号)
(1) 装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用
(填编号)
a. 防止NaNO2饱和溶液蒸发
b. 保证实验装置不漏气
c. 使NaNO2饱和溶液容易滴下
(2) B部分的作用是
a. 冷凝
b. 缓冲气流
c. 冷却氮气
(3) 加热前必须进行的一个操作步骤是(用文字说明) 加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 (用文字说明)
 (4) 收集N2前,必须进行的步骤是(用文字说明)
,收集氮气最适宜的方法是
。
(4) 收集N2前,必须进行的步骤是(用文字说明)
,收集氮气最适宜的方法是
。
a. 用排空气法收集在集气瓶中
b. 用排水法收集在集气瓶中
c. 直接收集在球胆或塑料袋中
(5) 实验室合成氨装置如图所示,试回答:装置甲的作用是
a.
b.
c.
从乙处导出的气体是
21.下面是某学生用已知浓度的盐酸溶液测定未知浓度的NaOH溶液的部分操作,其中错误的是
A. 取一锥形瓶,用待测NaOH溶液润洗两次后装入25 mL待测NaOH溶液
B. 加入几滴石蕊试液作指示剂
C. 取一支酸式滴定管,洗涤干净后直接往其中注入标准盐酸溶液
D. 滴定时,两眼注视滴定管内盐酸溶液液面下降,直至滴定终点
20.下列方程式属于水解反应的是 ( )
A. H2O+H2O  H3O++H+
H3O++H+
B. 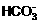 +H2O
+H2O H3O++
H3O++
C. 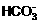 +OH-=H2O+
+OH-=H2O+
D.  +H2O
+H2O
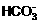 +OH-
+OH-
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com