
题目列表(包括答案和解析)
5、下列叙述正确的是
A.当组成物质的通式相同时,物质互为同系物
B.各元素的质量分数相同的物质一定是同系物
C.同系物之间互为同分异构体
D.两个相邻同系物的相对分子质量相差14
4、下列物质进行一氯取代反应后,只能生成四种沸点不同产物的烃是
A.(CH3)2CHCH2CH2CH3 B.(CH3CH2)2CHCH3
C.(CH3)2CHCH(CH3)2 D.(CH3)3CCH2CH3
3、C4H10可能有的同分异构体有
A.2种 B.3种 C.4种 D.5种
2、实验室制取下列各组气体时不可用同一种反应发生装置的是
A.NO、O2、SO2 B.Cl2、SO2、HCl
C.NH3、O2、CH4 D.H2S、CO2、H2
1、植物在隔绝氧气的情况下腐败,最后能产生
A.甲烷 B.氧气 C.CO2 D.酒精
1.氢化钙可以作为生氢剂,反应方程式如下:CaH2+2H2O Ca(OH)2+2H2↑其中水的作用是( )
Ca(OH)2+2H2↑其中水的作用是( )
A.既不是氧化剂也不是还原剂 B.是氧化剂
C.是还原剂 D.既是氧化剂又是还原剂
4.选准物质,跟踪配平
对某些复杂的分解反应和复杂有机物的燃烧和爆炸反应,可以选择复杂反应物,然后根据其各元素的原子数跟踪配平产物的系数(若系数出现分数,则要将其调整的为整数).
Fe(NO3)2
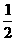 Fe2O3+2NO2+
Fe2O3+2NO2+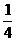 O2
O2
调整系数:4Fe(NO3)2 2Fe2O3+8NO2+O2
2Fe2O3+8NO2+O2
[重点难点解析]
例1:已知氧化还原反应式:NaNO2+NH4Cl-NaCl+N2↑+H2O,若得到mmol的N2,则电子转移数为 个,此时氧化产物与还原产物的质量之比为 .
分析:从反应式可知NaNO2中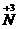 被还原为零价,NH4Cl中
被还原为零价,NH4Cl中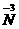 被氧化成零价,所以很快可以配平,即:NaNO2+NH4Cl
被氧化成零价,所以很快可以配平,即:NaNO2+NH4Cl NaCl+N2↑+2H2O,当电子转移数目为3mNA,由上述分析知氧化产物与还原产物均为N2,物质的量之比为1∶1,故其质量比为1∶1.
NaCl+N2↑+2H2O,当电子转移数目为3mNA,由上述分析知氧化产物与还原产物均为N2,物质的量之比为1∶1,故其质量比为1∶1.
本题答案:3mNA 1∶1
例2:配平H2O2+Cr2(SO4)3+ -K2SO4+K2CrO4+H2O
分析:对于缺项方程式,一般情况下缺项为水、酸、碱.比如KMnO4、硝酸盐参与的反应一般在酸性条件下,如果没有酸,那么水应参与,这时产物中会出现碱.如果试题中有提示信息,则难度会大大降低.一般来说,可先配平含变价元素物质的系数,再通过比较反应物与生成物所含原子或离子种类来确定缺项物质的化学组成,然后将其配平.本题左边缺项物质应含K+,而含K+的物质不是H2O,一般也不为酸,故为KOH,然后将其配平.
本题答案:3H2O2+Cr2(SO4)3+10KOH 3K2SO4+2K2CrO4+8H2O
3K2SO4+2K2CrO4+8H2O
例3:当Zn与某浓度的硝酸反应时,若参加反应的锌与硝酸的物质的量之比为2∶5时,则还原产物可能是( )
A.N2O B.NO C.NO2 D.N2O5 E.NH4NO3
分析:因为2Zn-5HNO3,不妨设用4mol Zn和10mol HNO3反应,4mol Zn失去电子4×2=8mol,而4mol Zn要生成4mol Zn(NO3)2,则应消耗HNO3 8mol,所以发生还原反应的硝酸可能有1mol或2mol.若2mol被还原,根据得失电子数相等的原则,则HNO3被还原为N2O.若1mol被还原,则还原产物为NH4NO3.
本题答案:AE
[难题巧解点拨]
例1:在反应:3BrF3+5H2O HBrO3+Br2+9HF+O2中,当有5mol水参加反应时,由H2O还原的BrF3为
mol;由BrF3还原的BrF3为
mol;被还原的BrF3为
mol.
HBrO3+Br2+9HF+O2中,当有5mol水参加反应时,由H2O还原的BrF3为
mol;由BrF3还原的BrF3为
mol;被还原的BrF3为
mol.
分析:本题解答除需理解还原、被还原的概念,弄清电子转移关系外,还要认真审题,注意措辞,方能得到正确答案.
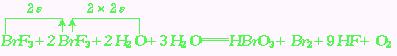
当有5mol水参加反应时,有6mol电子转移,其中由水还原的BrF3为4/3mol,由BrF3还原的BrF3为2/3mol,总的被还原的BrF3为(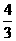 mol+
mol+ mol)=2mol.
mol)=2mol.
例2:在反应:3BrF3+5H2O HBrO3+Br2+9HF+O2中,当有5mol水作还原剂参加化学反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
HBrO3+Br2+9HF+O2中,当有5mol水作还原剂参加化学反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
分析:当有2mol水作还原剂时,由水还原的BrF3为4/3mol,现有5mol水作还原剂时,则由水还原的BrF3为10/3mol,由BrF3还原的BrF3为5/3mol,总的被还原的BrF3为5mol.
例3:在反应:3BrF3+5H2O HBrO3+Br2+9HF+O2中,当有5mol水未参加氧化还原反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
HBrO3+Br2+9HF+O2中,当有5mol水未参加氧化还原反应时,由水还原的BrF3为
mol;由BrF3还原的BrF3为
mol;总的被还原的BrF3为
mol.
分析:当有3mol水未参加氧化还原反应时,由H2O还原的BrF3为4/3mol,现有5mol水未参加氧化还原反应,则被水还原的BrF3为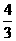 mol×
mol×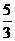 =
=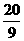 mol,由BrF3还原的BrF3为10/9mol,总的被还原的BrF3为(
mol,由BrF3还原的BrF3为10/9mol,总的被还原的BrF3为(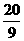 mol+
mol+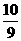 mol)=
mol)=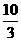 mol.
mol.
[命题趋势分析]
本节考点有两个,一是氧化还原化学方程式的配平,二是有关氧化还原反应的计算.
[典型热点考题]
3.同种元素的化合价变化,只相邻不相交
同种元素间发生的氧化还原反应,化合价升降后一般变成相邻状态,或是同处于高价(氧化剂)和低价(还原剂)中间的某一价态,而不可能出现化合价的交叉现象,如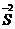 和
和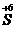 之间的变化,一般是
之间的变化,一般是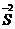

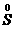 、
、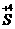

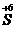 ,也可能是
,也可能是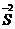

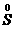

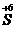 或
或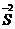

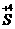

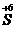 ,但不可能是
,但不可能是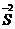

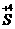 ,
,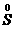

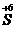 ,更不可能是
,更不可能是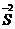

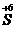 .
.
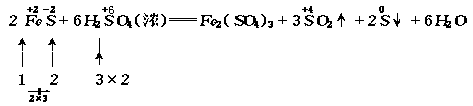
其中FeS中的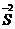 被氧化成S,H2SO4中的
被氧化成S,H2SO4中的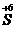 被还原为SO2,Fe2(SO4)3中的SO42-由H2SO4提供.
被还原为SO2,Fe2(SO4)3中的SO42-由H2SO4提供.
2.多种变价,合并计算
如果同一分子内有多种元素的化合价发生升降变化,可把这个分子当整体,合并计算此分子内化合价升高或降低的总值.
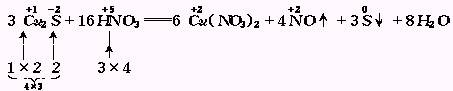
1.自身反应,逆向配平
如果化合价有升降的元素是同一物质中的同种元素,或氧化剂、还原剂是同一种物质时,可从生成物的一边进行配平,首先确定氧化产物、还原产物的系数.
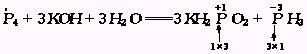
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com