
题目列表(包括答案和解析)
4.下列叙述正确的是
A.常温下铝和浓硫酸、浓硝酸不反应
B.工业上常利用铝热反应冶炼难熔的金属,如钒、铬、锰等
C.合金的熔点一般比组成它的各成分的熔点都高
D.两份相同质量的铝粉,分别与足量的稀硫酸和氢氧化钠溶液反应时,产生的氢气前者较多
3.下列叙述中,正确的是 A.含金属元素的离子一定都是阳离子 B.在氧化还原反应中,非金属单质一定是氧化剂 C.某元素从化合态变成游离态时,该元素一定被还原 D.金属阳离子被还原不一定得到金属单质
2. 下列不能由单质直接化合而得到的化合物是
A. FeCl2 B. Al2S3 C. FeS D. Fe3O4
1.用铝热法还原下列化合物,制得金属各1mol,消耗铝最少的是
A.Fe3O4 B.MnO2 C. WO3 D.Cr2O3
40.为使溶液中的三种阳离子A+、B2+、C3+逐一沉淀分离,将含有A+、B2+、C3+三种阳离子的水溶液进行如下实验
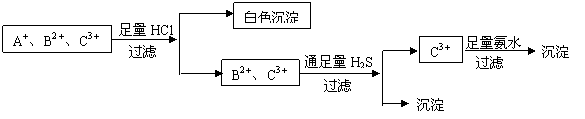
(1)写出过滤操作用到的玻璃仪器名称: 。
(2)C3+可能是Al3+或Fe3+吗?为什么?
(3)B2+离子可能是Fe2+吗?为什么?
39.为确定某铝热剂(含三氧化二铁和铝)的组成,分别进行下列实验。
⑴ 若取a g样品,向其中加入足量的NaOH溶液,测得生成的气体(标况,下同)体积为b L。反应
的化学方程方式 ;
样品中铝的质量是 g。
⑵ 若取a g样品将其点燃,恰好完全反应,该反应的化学方程式是
三氧化二铁和铝的质量比是 。
⑶ 待⑵中反应产物冷却后,加入足量盐酸,测得生成的气体体积为cL,该气体与⑴中所得气体的体积比c︰b= 。
38.在100mL 0.6mol·L-1 AlCl3溶液中,滴加475mL 0.4mol·L-1 NaOH溶液,计算所得Al(OH)3的质量为 克.
37.某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH为11,则该温度下水的KW=_________ 在此温度下,将pH=a的NaOH溶液V(a)L与pH=b的H2SO4 溶液V(b)L混合(不考虑混和后体积变化)。
(1)若所得混合液为中性,且a=12,b=2,则V(a):V(b)= ___________;
(2)若所得混合液为中性,且a+b=12,则V(a):V(b)= ____________;
(3)若所得混合液的pH=10,且a=12,b=2,则V(a):V(b)= _________。
34.工业上冶炼金属一般用以下几种方法,①热还原法②电解法③热分解法④铝热法。现冶炼下列金属,请选择适宜的冶炼方法(填序号):
Al、Mg ,Fe、Cu ,Mn、Cr ,Hg、Ag 。
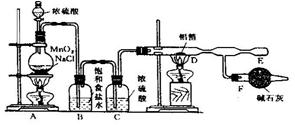 35.无水氯化铝是白色晶体,易吸水,在178℃升华。无水氯化铝试剂在潮湿的空气中,会产生大量的白雾。制备无水的氯化铝可以采用下面的两种方法。
35.无水氯化铝是白色晶体,易吸水,在178℃升华。无水氯化铝试剂在潮湿的空气中,会产生大量的白雾。制备无水的氯化铝可以采用下面的两种方法。
 方法一:某课外兴趣小组在实验室用铝和氯气反应制备:
方法一:某课外兴趣小组在实验室用铝和氯气反应制备:
(1)装置B的作用是 ,
装置F的作用是 。
(2)在E处可收集到纯净的氯化铝,其原因是
(3)无水氯化铝在潮湿空气中发生的反应方程式为
方法二:从矿石中提取AlCl3溶液,将溶液蒸发浓缩结晶可得到AlCl3·6H2O。
(1)若将AlCl3溶液直接蒸干能否得到无水氯化铝?
(2)由AlCl3·6H2O制取无水氯化铝的方法是
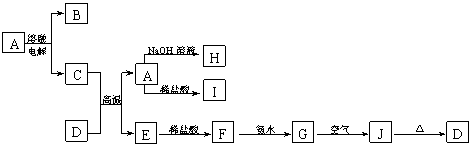 36.A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀,H的焰色反应呈黄色。
36.A-J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀,H的焰色反应呈黄色。
请回答下列问题:
(1)A物质的化学式为 ,H物质的名称为 。
(2)G→J的化学方程式为 。
(3)C+D→A+E的化学方程式为 。
(4)D物质与盐酸反应的离子方程式为 ,
所得溶液显酸性的原因(用离子方程式表示)是 。
33.在一定条件下,反应A(气)+B(气) C(气) ( 正反应放热)
达到平衡后,根据下列图象判断
C(气) ( 正反应放热)
达到平衡后,根据下列图象判断
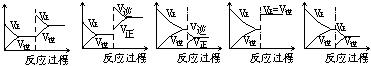
A. B. C. D. E.
(1)升温,达到新的平衡的是 ;(2)降压,达到新的平衡的是 ;
(3)减少C的量,移向新平衡的是 ;(4)增加A的量,移向新平衡的是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com