
题目列表(包括答案和解析)
21.常温下某强酸溶液pH=a,强碱溶液pH=b,已知a+b=12,酸碱溶液混合pH=7,求酸溶液体积V(酸)和碱溶液体积V(碱)的关系?(要求写出计算过程)

20. (12分)写出下列离子方程式。
(1) Na2CO3水解的离子方程式为:
(2) FeCl3 水解的离子方程式为:
(3) CH3COONa水解的离子方程式为:
(4) NaHCO3溶液与Al2(SO4)3 溶液反应的离子方程式为:
19.(6分)若以铁棒、碳棒、导线和氯化铁溶液为用品设计原电池。
负极材料为_________,电极反应式为____________________;正极材料为__________,电极反应式为____________________。
18.(4分)有四种一元酸HA、HB、HC、HD,相同物质的量浓度的NaD和NaB溶液的pH,前者比后者大,NaA溶液呈中性,1mol/L的KC溶液遇酚酞试液呈红色;同体积、同物质的量浓度的HB、HC用样的装置分别作导电性试验,发现后者的灯泡比前者亮,则这四种酸的酸性由强到弱的顺序为________________________。
17.(18分)现用中和滴定测定某NaOH溶液浓度。
(1)滴定:①用 式滴定管盛装a mol/L盐酸标准液。右图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
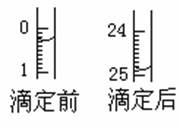
②有关数据记录如下:
|
滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
|
滴定前 |
滴定后 |
消耗的体积 |
||
|
1 |
20.00 |
0.50 |
25.00 |
24.50 |
|
2 |
20.00 |
|
|
|
(2)计算:根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
c(NaOH) = (用含a的式子表示)。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
16.某溶液中在25℃由水电离出的氢离子浓度为1×10-12mol/L,下列说法正确的是
A.HCO3-离子在该溶液中不能大量共存
B.该溶液的pH可能是2或12
C.向该溶液中加入铝片后,一定能生成氢气
D.若该溶液的溶质只有一种,它一定是酸或碱
15.已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH
 CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
A.加少量烧碱溶液 B.升高温度 C.加少量冰醋酸 D.加水
14.下列溶液中各微粒的浓度关系不正确的是
A.0.1 mol·L-1 HCOOH溶液中:c(HCOO-)+c(OH-)=c(H+)
B.1 L 0.l mol·L-1CuSO4·(NH4)2SO4·6H2O的溶液中:
c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.0.1 mol·L-1NaHCO3溶液中: c(Na+)+c(H+) =c(HCO3-)+c(CO32-)+c(OH-)
D.等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中:
c(Na+)>c(HX)>c(X-)>c(H+)>(OH-)
13.某原电池总反应为:Cu+2Fe3+==Cu2++2Fe2+ 下列能实现该反应的原电池是( )
|
|
A |
B |
C |
D |
|
电极材料 |
Cu、Zn |
Cu、C |
Fe、Zn |
Cu、Ag |
|
电解液 |
FeCl3 |
Fe(NO3)2 |
CuSO4 |
Fe2(SO4)3 |
12、在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
A.c (Na+)==c(CH3COO-)+c(CH3COOH)
B.c(H+)==c(CH3COO-)+c(OH一)
C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+)
D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com