
题目列表(包括答案和解析)
21.(1)__________ (2)________ (3)_____________
28.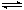 (6分) 反应2A(g)+B(g) 3C(g),起始时按5:2的体积比把A,B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达平衡时混合气体中C的体积分数为60%。(1)A的转化率为
,B的转化率为
;(2)平衡时压强与起始时压强之比为 。
(6分) 反应2A(g)+B(g) 3C(g),起始时按5:2的体积比把A,B两气体混合后,充入一体积不变的密闭容器中,在恒定温度下使其反应,达平衡时混合气体中C的体积分数为60%。(1)A的转化率为
,B的转化率为
;(2)平衡时压强与起始时压强之比为 。
天津市五校09-10学年高二上学期期中联考化学答题纸
Ⅰ、选择题
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
Ⅱ、选择题
|
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
|
|
|
|
|
|
|
|
|
|
Ⅲ、填空题
27.(10分)向某恒容密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示[已知t0-t1阶段c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,在t2、t3、t4、t5时刻各改变一种不同的条件,已知t3时刻为使用催化剂。
(1)若t1 = 15 s,则t0-t1阶段的反应速率为v(C) = _____________。
(2)t4时刻改变的条件为______________,B的起始物质的量为___________。
(3)写出该反应的化学方程式__________________________,该反应的逆反应为________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ-Ⅴ五处平衡,其平衡常数与Ⅰ处的平衡常数不相等的是_____________(填“Ⅱ”、“Ⅲ”、“Ⅳ”或“Ⅴ”)。
(5)在相同条件下,若按下表a、b、c、d四种情况进行投料,达到的平衡与t1时刻的平衡等效(A、B、C的体积分数分别与t1时刻的平衡相同)的是___________(填“a”、“b”、“c”或“d”)
|
|
a |
b |
c |
d |
|
n(A)/mol |
2.0 |
1.2 |
2 |
3.6 |
|
n(B)/mol |
1.2 |
0.4 |
1 |
1.5 |
|
n(c)/mol |
0.1 |
0 |
0.5 |
2 |
26.(11分)下图是用0.1000 mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置。请回答:
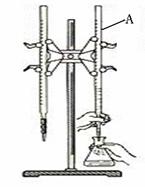
 ⑴ 仪器A的名称是
;
⑴ 仪器A的名称是
;
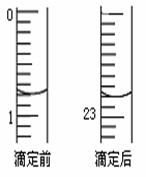
⑵ 盐酸的体积读数:
滴定前读数为 mL,
滴定后读数为 mL 。
⑶ 某实验小组同学的三次实验的实验数据如下表所示。 根据表中数据计算出的待测NaOH溶液的平均浓度是 mol/L。(保留四位有效数字)
|
实验 编号 |
待测NaOH溶液的体积(mL) |
滴定前盐酸的 体积读数(mL) |
滴定后盐酸的 体积读数(mL) |
|
1 |
20.00 |
1.20 |
23.22 |
|
2 |
20.00 |
2.21 |
24.21 |
|
3 |
20.00 |
1.50 |
23.48 |
⑷ 滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00 mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准HCl溶液注入酸式滴定管至刻度0以上2~3 cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准HCl溶液滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)________
⑸ 判断到达滴定终点的实验现象是_____________ 。
⑹ 对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
① 如果上述B步骤省略,对测定结果的影响是 。
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失。_________
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是 ;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是 ;
25.(6分)(1) 某温度下纯水中的c(H+) = 2×10-7mol/L,则此时c(OH-) =________mol/L,该纯水的pH_______(填“>7”、“<7”、“=7”)。若温度不变,滴入稀硫酸使c(H+) = 5×10-6mol/L,则c(OH-) =________mol/L,由水电离出的c(H+) =________mol/L,
(2)已知在室温下,盐酸的pH=a,氢氧化钡的pH=b,且a+b=14,两者等体积混合后,溶液的pH= 。
若酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
24. (6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。
(6分)(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0 kJ·mol-1;由N2和H2合成1mol NH3时可放出46.2kJ的热量。 N-H键的键能是_________
N-H键的键能是_________
 (2)发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
(2)发射卫星用N2H4气体为燃料,NO2气体为氧化剂,两者反应生成N2和水蒸气,已知:
 N2 (g)+2O2
(g) = 2NO2 (g) △H1=+67.7 kJ·mol-1;
N2 (g)+2O2
(g) = 2NO2 (g) △H1=+67.7 kJ·mol-1;
 2H2 (g)+O2
(g) = 2H2O(g) △H2=-484 kJ·mol-1;
2H2 (g)+O2
(g) = 2H2O(g) △H2=-484 kJ·mol-1;
 N2H4
(g)+O2 (g) = N2 (g)+2H2O(g) △H3=-534 kJ·mol-1;
N2H4
(g)+O2 (g) = N2 (g)+2H2O(g) △H3=-534 kJ·mol-1;
 H2 (g)+F2
(g) = 2HF(g) △H4=-538 kJ·mol-1;
H2 (g)+F2
(g) = 2HF(g) △H4=-538 kJ·mol-1;
 H2O(1) = H2O(g)
△H5= + 44.0 kJ·mol-1。
H2O(1) = H2O(g)
△H5= + 44.0 kJ·mol-1。
① 写出N2H4气体与NO2气体反应生成氮气和液态水的热化学方程式:

 ②写出N2H4气体与F2气体反应的热化学方程式
。
②写出N2H4气体与F2气体反应的热化学方程式
。
23.(2分)燃烧a g乙醇(液态)生成CO2气体和液态H2O,放出热量为Q kJ,经测定a g乙醇与足量Na反应能生成H2 5.6 L(标准状况下),则表示乙醇燃烧热的热化学方程式为 (△H的值不用a表示)
22.
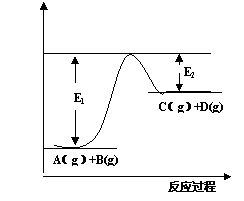 (6分)反应A(g)+B(g)
(6分)反应A(g)+B(g)  C(g) +D(g)
C(g) +D(g)
过程中的能量变化如图所示,回答下列问题。
(1)该反应是__________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,
正反应速率______,逆反应速率_________。
(填“增大”“减小”“不变”)
(3)反应体系中加入催化剂对
反应热是否有影响_______________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________(填“增大”“减小”“不变”) 。
21.(3分)现有下列物质 ①NaCl晶体 ②液态SO2 ③纯醋酸 ④硫酸钡
⑤铜 ⑥酒精(C2H5OH) ⑦熔化的KCl ⑧NaOH溶液 请用以上物质回答下列问题。(填序号) (1)属于强电解质且在上述状态下能导电的是 ; (2)属于弱电解质的是 ; (3)属于非电解质,但溶于水后的水溶液能导电的是 ;
20.pH=1的两种一元酸HX和HY的溶液,分别取50mL,加入足量的镁粉,
充分反应,收集的氢气的体积分别为V(HX)和V(HY),若V(HX)>V(HY),下
列说法正确的是( )
A.HX一定是弱酸 B.HY一定是强酸
C.HX的酸性强于HY的酸性 D.反应开始时二者生成H2的速率不相同
Ⅲ、填空题(共50分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com