
题目列表(包括答案和解析)
[知识要点]
第 一 讲:一、物质的组成、性质和分类
26.(11分)硫酸是极其重要的化工原料,在工业、农业、医药、军事等领域应用广泛。工业上通常用接触法制硫酸,主要原料是硫铁矿和空气。接触法制硫酸的生产过程大致可分为三个阶段:二氧化硫的制取和净化;二氧化硫转化为三氧化硫;三氧化硫的吸收和硫酸的生成。
问题1:设空气中N2、O2的含量分别为0.80和0.20(体积分数),则110 L空气和足量的FeS2完全反应后,气体体积(同温同压)变为___________L。
问题2:为了防止环境污染并对尾气进行综合利用,硫酸厂常用氨水吸收尾气的SO2、SO3等气体,再向吸收液中加入浓硫酸,以制取高浓度的SO2及(NH4)2SO4和NH4HSO4固体。
为了测定测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液50.00 mL,加热至120℃左右,使氨气全部逸出[(NH4)2SO4和NH4HSO4的分解温度均高于200℃],测得有关实验数据如下(标准状况):
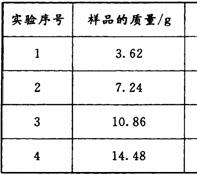
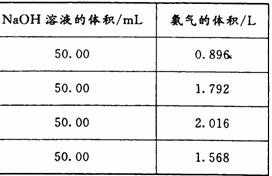
⑴由1组数据直接推测:1. 81 g样品进行同样实验时,生成氨气的体积(标准状况)为__________L。
⑵试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比为___________。
⑶求所用NaOH溶液的物质的量浓度。(写出计算过程)

25.(7分)无水CoCl2为深蓝色固体,吸水后变为粉红色的水合物,水合物受热后又变成无水CoCl2,故常在实验室中用作吸湿剂和空气湿度指示剂。
CoCl2 CoCl2·x H2O
CoCl2·x H2O
深蓝色 粉红色
⑴现有32.5 g无水CoCl2,吸水后得到59.5 gCoCl2·x H2O,则水合物中x的值是____。
⑵准确称量某有机物样品1.6 g,充分燃烧只生成二氧化碳和水,将燃烧产物通过足量的CoCl2,固体的质量增加1.88 g;再通过足量的碱石灰,碱石灰质量增加2.2 g,则该有机物的最简式为______________;该样品的分子式________(填“能”或“不能”)确定,理由是___________________________________________________________。
22.(10分)已知A是一种由短周期元素组成的盐,H是引起温室效应的主要气体之一,Y是一种常见液体,E的相对分子质量比D大16,L、K均为白色沉淀,且K光照后无变化。它们存在如下转化关系(反应条件及部分产物已略去):
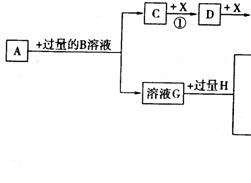
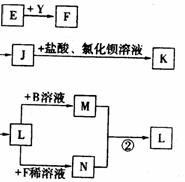
请回答下列问题:
⑴A的化学式是___________,Y的电子式是__________。
⑵反应①的化学方程式是____________________________。
⑶反应②的离子方程式是____________________________。
⑷将L加热后得到的固体在熔融条件下电解的化学方程式是____________________。
21.(8分)A、B、C、D四种短周期元素,原子序数依次增大,离子半径依次减小,A与C可形成原子个数比分别为l∶1和1∶2的两种离子化合物,A与D的原子序数之和等于B与C的原子序数之和,请回答下列问题:
⑴写出元素符号:B________,D________。
⑵A、C形成的离子化合物与CO2发生氧化还原反应的化学方程式:________。
⑶1 mol C的氢氧化物与1 mol B单质在一定条件下恰好完全反应,生成一种盐、水及一种气体,写出该反应的化学方程式:________________________________。
⑷B、C形成的化合物溶于水时,溶液中所有离子的物质的量浓度由大到小的顺序为_____________________________________。
20.(14分)实验室用加热l-丁醇、溴化钠和浓H2SO4的混合物的方法来制备1-溴丁烷时,还会有烯、醚等副产物生成。反应结束后将反应混合物蒸馏,分离得到1-溴丁烷,已知相关有机物的性质如下:
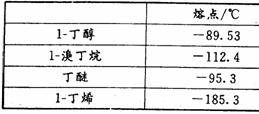
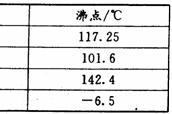
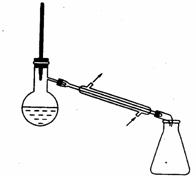
A B C D
⑴反应中由于发生副反应而生成副产物的有机反应类型有_________________。
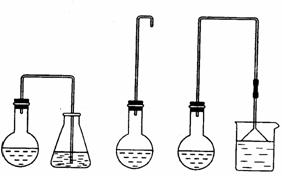
⑵制备1-溴丁烷的装置应选用上图中的_______(填序号)。反应加热时的温度不宜超过100℃,理由是__________________________;较好的加热方法是_____________。
⑶当给烧瓶中的混合物加热时,溶液会出现橘红色,其原因是_____________。
⑷反应结束后,将反应混合物中1-溴丁烷分离出来,应选用的装置是______。该操作应控制的温度(t)范围是_______________。
19.(6分)下列有关化学实验的操作或说法中,正确的是(填字母代号)________。
A.实验室制肥皂时,将适量植物油、乙醇和NaOH溶液混合,并不断搅拌、加热,直到混合物变稠,即可得到肥皂
B.进行中和热测定实验时,需要测出反应前盐酸和NaOH溶液的温度及反应后溶液的最高温度
C.检验红砖中的氧化铁成分时,向红砖粉末中加入盐酸,放置至充分沉淀后,取上层清液于试管中,滴加KSCN溶液2滴-3滴即可
D.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸发滤液即可得硫酸亚铁晶体
E.进行纤维素水解实验时,把一小团蓬松脱脂棉放入试管,滴入少量浓硫酸搅拌,使脱脂棉编成糊状,再加入一定量的水,加热至溶液呈亮棕色,然后加入新制的Cu(OH)2加热至沸腾即可
18.向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
⑤其他条件不变,向容器中再加入1 molC气体,达到新平衡时,C的体积分数不变
A.①②③ B.①③⑤ C.②④⑤ D.①③④
第Ⅱ卷(非选择题 共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com