
题目列表(包括答案和解析)
1.今年3月29 日,京沪高速淮安段,发生一起违章驾驶相撞,使槽罐车中32t液氯快速泄漏,造成大批人员伤亡、大片农田被毁和重大经济损失的恶性案件。对于在事故发生时的下列各种应急处理,你认为正确的是
A、附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向逃逸或向避风的沟塘低洼处转移
B、要快速地将翻落的氯槽罐安全起吊移至水池,进行碱液稀释中和
C、液氯的流淌速度很慢,居民不必惊慌,可以放心地撤退到家中,关紧门窗
D、检修或现场抢救时,如果没有防毒面具,可以佩戴用浓的烧碱溶液浸泡过的湿口罩
26. (8分)铁粉和铜粉的均匀混合物,平均分成三等份,分别加入同浓度的稀硝酸,充分反应,在标准状况下生成NO的体积和剩余金属的质量如下表(设硝酸的还原产物只有NO):
|
编号 |
① |
② |
③ |
|
稀硝酸体积/mL |
100 |
200 |
300 |
|
剩余金属/g |
30.4 |
22 |
12.8 |
|
NO体积/mL |
2240 |
4480 |
6720 |
由上述数据推测:
(1)求硝酸的物质的量浓度。
(2)③中溶解金属的成分是什么?其相应的质量为多少克?
(3)向反应后的①中加入足量的该稀硝酸时,又生成气体的体积在标准状况下为多少L?
25. (6分)将12.6克无水亚硫酸钠固体加入100 mL 8 mol·L-1的硫酸中以制取SO2气体,反应完全后,若溶液中含+4价硫元素的物质的总浓度为0.2 mol·L-1,假定溶液体积不变,忽略容器及导管中的气体体积,求:
(1)反应完全后溶液中硫元素的质量.
(2)收集到SO2气体的体积(标准状况下)。
24.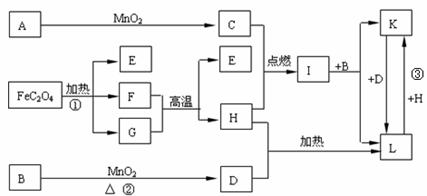 (10分)下列A-L
11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1
mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
(10分)下列A-L
11种物质是中学化学常见物质,其中C、D、E、F为气体,C、D、H为单质。1 mol FeC2O4在反应①中转移1
mol电子。它们有如下图所示的转化关系(部分反应中的生成物已略去),试回答:
(1) 写出有关物质的化学式:A__________、I____________。
(2) 写出反应①中化学方程式_____________________________________________。
(3)写出反应②中化学方程式_____________________________________________。
(4) 写出反应③中的离子方程式 。
23.(8分)主族元素A、B、C、D、E、F的原子序数依次增大且不超过20 ,其中A、E同主族,C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,C是短周期元素中原子半径最大的主族元素。C、D、E三元素的最高价氧化物的水化物两两之间可以反应生成盐和水。试回答下列问题:
(1)A在元素周期表中的位置 。
(2)C、D两元素的最高价氧化物的水化物之间反应的离子方程式为:
。
(3)E元素的最高价氧化物的水化物在工业上有重要的用途,工业上合成E元素的最高价
氧化物时的反应条件是 。
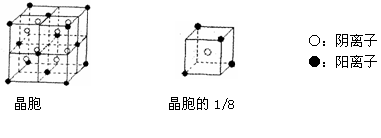
(4)B和F可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结
构如下图所示,该化合物的电子式是 。
22.(8分)在一定温度下,将2mol A和2molB
两种气体相混合于容积为2L的某密闭容器中,发生如下反应:3A(气)+B(气)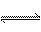 2 C (气)+2D(气),5min后反应达到平衡状态,生成了0.8mol D,请填写下列空白:
2 C (气)+2D(气),5min后反应达到平衡状态,生成了0.8mol D,请填写下列空白:
(1)用A表示的化学反应速率为 ,B体积分数为 。
(2)如果上述反应在相同条件下,开始加入C和D均为4/3mol,要使平衡时各物质的物质的量浓度与原平衡时相等,则还应加入A__ _mol,B__ _mol。
(3)如果上述反应在相同条件下,开始加入C和D均为2mol,要使平衡时各物质的体积分数与原平衡时相等,若还应加入A为amol,B为bmol,则a、b必须满足的关系是:
_________________________ ,此时C的浓度为_________mol/L。(用a或b表示)
21.(14分)(1)某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中的还原剂是 该反应中,发生还原反应的过程是 → 。
②写出该反应的化学方程式,并标出电子转移的方向和数目:
③在H2O2中加入乙醚(溶剂,不参与反应)后,再加入数滴K2Cr2O7的硫酸溶液,轻轻振荡后静置,乙醚层呈现现蓝色,这是由于生成的CrO5溶于乙醚的缘故。已知CrO5是含有过氧键(-O-O-)的共价化合物,且Cr的化合价为+6。
 a.在1mol CrO5中过氧键(-O-O-)的物质的量为________,
a.在1mol CrO5中过氧键(-O-O-)的物质的量为________,
请在右面的方框中画出其结构式。
 b.写出这一反应的离子方程式________________________
。
b.写出这一反应的离子方程式________________________
。
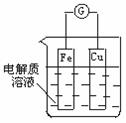
(2) 如图所示,组成一个原电池。
①当电解质为稀硫酸时:
电极Fe上的电极反应为 ;
②当电解质为稀硝酸时:
电极Cu上的电极反应为____ 。
20.(12分)某学生用胆矾制取氧化铜固体,并研究氧化铜能否在氯酸钾受热分解实验中起催化作用。实验步骤如下:
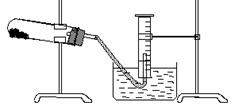 ①称量a g胆矾固体放入烧杯中,加水制成溶液,
①称量a g胆矾固体放入烧杯中,加水制成溶液,
向其中滴加氢氧化钠溶液至沉淀完全;
②把步骤①中的溶液和沉淀转移至蒸发皿中,加热
至溶液中的沉淀全变成黑色氧化铜为止;
③过滤、洗涤、干燥,称量所得固体质量为b g;
④取一定质量的上述氧化铜固体和一定质量的氯酸钾固体,混合均匀后加热,收集反应生成的氧气,如上图所示。请回答下列问题:
(1)上述各步操作中,需要用到玻璃棒的是__________(填写前面所述实验步骤的序号)。
(2)由胆矾制备氧化铜的产率(实际产量与理论产量的百分比)为____________×100%。
(3)为保证Cu2+沉淀完全,步骤①中溶液的pH应大于10。简述测定溶液pH的操作:
。
(4)为证明氧化铜在氯酸钾的分解反应中起催化作用,在上述实验①-④后还应该进行的实验操作是 (按实验先后顺序填写字母序号)。
a 过滤 b 烘干 c 溶解 d 洗涤 e 称量
(5)但有同学认为,还必须另外再设计一个实验才能证明氧化铜在氯酸钾受热分解的实验中起催化作用。你认为还应该进行的另一个实验是
。
19.(10分)(1)下列是某学习小组的同学关于某无色溶液中所含离子鉴别的实验设计方案。请指出存在问题的实验方案,并说明理由(有几组写几组,不一定填满,多写倒扣分)。
A.加入KSCN溶液后,溶液不显红色,再加几滴氯水,溶液颜色变为红色。说明原溶液中含Fe2+
B.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,可确定有SO42-存在
C.通入Cl2后,溶液由无色变为黄色,加入淀粉溶液后溶液变蓝,可确定有I-存在
D.加入盐酸后,生成的气体能使澄清石灰水变浑浊,则原溶液中一定有CO32-
E.加入浓NaOH溶液并加热,产生使湿润红色石蕊试纸变蓝的气体,说明溶液中含NH4+
① 。
② 。
③ 。
 (2)实验室配制95mL0.100mol/LCuSO4溶液,回答下列问题:
(2)实验室配制95mL0.100mol/LCuSO4溶液,回答下列问题:
①用电子天平(如下图)称取硫酸铜晶体时读数应是 g 。
(该天平最小读数是1mg,不需估读)
②使用容量瓶配制溶液时,下列情况会使所配溶液浓度偏低的
是_________________。
A.称重前发现晶体有风化(失去部分或全部结晶水)的现象
|
C.液转移到容量瓶后,烧杯及 玻璃棒未用蒸馏水洗涤
D.定容时,俯视容量瓶的刻度线
E.容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
18.CuCO3 和Cu2(OH)2CO3的混合物34.6 g ,可恰好完全溶解于300ml、2 mol.L-1的盐酸溶液中,加热分解等量的这种混合物可得CuO
A.16.0 g B.19.2 g
C.24.0 g D.30.6 g
第Ⅱ卷(非选择题(共76分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com