
题目列表(包括答案和解析)
3.关于工业生产的下列叙述中,不正确的是
A.工业生产硫酸时,使用热交换器可以充分利用反应中所放出的热量
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.工业上用离子交换膜法电解饱和食盐水制烧碱
D.工业上采用电解熔融氯化铝的方法制取金属铝
2.下列各化学式既能表示物质的化学组成,又能表示物质分子式的是
①Mg,②NH4NO3,③CH2O,④SiO2,⑤C6H5NO2,⑥Al2O3,⑦NH3·H2O,⑧P,
⑨Ag(NH3)2OH,⑩HgCl2。
A.①②⑤⑧ B.③⑤⑦⑩ C.③④⑦⑧ D.③⑤⑥⑨
1.俄罗斯杜布纳核联合研究所和美国劳伦斯利弗莫尔国家实验室的科学家在2004年2月的美国《物理评论C》杂志上发表文章宣布, 他们新合成了元素周期表上的第115号和第113号元素。科学家在利用回旋加速器进行的实验中,用具有20个质子的钙元素的同位素反复轰击含95个质子的镅元素,结果4次成功制成4个第115号元素的原子。这4个原子在生成数微秒后衰变成第113号元素。前者的一种核素为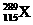 。下列有关叙述正确的是
。下列有关叙述正确的是
A.115号元素衰变成113号元素是化学变化
B.核素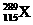 中中子数与质子数之差为174
中中子数与质子数之差为174
C.113号元素最高正价应为+3
D.115号与113号元素的原子质量比为115∶113
3、电解的计算特点
有关电解的计算通常是求电解后某产物的质量、气体的体积,某元素的化合价以及溶液的pH、物质的量浓度等。解答此类题的方法有两种:一是根椐电解方程式或电极反应式,应用阴、阳两极得失电子守恒进行有关计算。二是用惰性电极进行电解的过程,若电解质的阴、阳离子不同时在两极上放电,则阳离子放电的同时必有H+生成,n(H+)=n(阳离子)×电荷数;阴离子放电的同时必有OH―生成,n(OH―)=n(阴离子)×电荷数。也可利用物质的量相当量的关系(由电子得失守恒得),如,H2-Cl2-1/2O2-Cu-2Ag-2H+-2OH―。
※ 例题精析
[例1](1)美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧
燃料电池的突出优点是把化学能直接转变为电能,而不经过热能中间形式,且电极反应产生
的水,经过冷凝后又可作为宇航员的饮用水,发生的反应为:2H2+O2====2H2O, 则负极
通的是 ,正极通的是 ,正、负极两极电极反应式分别为:
, 。
(2)如把KOH改为稀H2SO4作导电物质,则电极反应式 ,
。(1)和(2)的电池液不同,反应进行后,其溶液的pH各有何变化? 。
(3)如把H2改为CH4,KOH作导电物质,则电极反应式为:
, 。
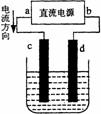 [例2]右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
[例2]右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
则下列有关的判断正确的是 ( )
A a为负极、b为正极 B a为阳极、b为阴极
C 电解过程中,d电极质量增加 D 电解过程中,氯离子浓度不变
1、 电解实例及规律
用惰性电极电解电解质溶液的规律
①电解水型:有含氧酸(如H2SO4、HNO3等)、强碱(NaOH、Ba(OH)2等)、活泼金属的含氧酸盐(如K2SO4、NaNO3、Na3PO4)这三类物质。
②电解电解质型:有无氧酸(除HF外,如HCl、HBr等)、不活泼金属的无氧酸盐(如CuCl2等)。
③电解质和水均被电解:活泼金属的无氧酸盐(如NaCl等)、不活泼金属的含氧酸(如CuSO4等)。
2电解应用
(1) 氯碱工业--电解饱和食盐水制取氯气和烧碱
① 原理:阳极(用石墨):2Cl― -2e-=Cl2 ↑ 阴极(用Fe):2 H+ + 2e-= H2 ↑

 总反应:2NaCl + 2 H2O
总反应:2NaCl + 2 H2O
 2NaOH
+H2↑+Cl2↑
2NaOH
+H2↑+Cl2↑
(阴极室中)(阳极室中)
②饱和食盐水的精制:电解前应除去食盐溶液中的Ca2+、Mg2+、SO42―等杂质离子,加入试剂依次为NaOH溶液、BaCl2溶液、Na2CO3溶液、稀盐酸(或将BaCl2溶液和NaOH溶液的顺序互换)。
③离子交换膜法制烧碱
离子交换膜电解槽主要由阳极(用金属钛网制成,涂有钛、钌等氧化物涂层)、阴极(由碳钢网制成,上面涂有镍涂层)、离子交换膜、电解槽框、导电铜棒等组成。
离子交换膜的特性:只允许阳离子通过,而阻止阴极离子和气体通过。
(2)铜的电解精炼
阳极(用粗铜):Zn-2e-= Zn2+ 、Fe -2e-= Fe2+、Ni-2e-= Ni2+、Cu-2e-= Cu2+
另外,粗铜中的金、银等金属杂质,因为失去电子能力比Cu弱,难以在阳极失去电子变成阳离子溶解下来,而以阳极泥的形式沉积下来。
阴极(用纯铜):Cu2+ + 2e- = Cu
电解质溶液用CuSO4或CuCl2溶液。长时间电解后,电解质溶液必须补充。
(3)电镀
电镀是一种特殊的电解,要求镀件必须作阴极,镀层金属作阳极,含镀层金属离子的可溶性盐溶液作电解质溶液(作为电镀液)。电镀时,理论上电解质溶液的浓度保持不变。
(4)电解法冶炼活泼金属
Na、Mg、Al等活泼金属都可用电解它们的熔融盐或氧化物制得。
2NaCl  2Na
+Cl2↑(制Na) MgCl2
2Na
+Cl2↑(制Na) MgCl2 Mg
+Cl2↑(制Mg)
Mg
+Cl2↑(制Mg)
2Al2O3 4Al+3O2↑(制Al)
4Al+3O2↑(制Al)
2、金属的腐蚀与防护
(1) 化学腐蚀与电化腐蚀
|
|
化学腐蚀 |
电化腐蚀 |
|
定义 |
金属或合金直接与具有腐蚀性的化学物质接触发生氧化还原反应而消耗的过程。 |
不纯金属或合金与电解质溶液接触发生原电池反应而消耗的过程。 |
|
本质 |
无电流 |
有弱电流 |
|
现象 |
金属被腐蚀 |
较活泼金属被腐蚀 |
|
实例 |
金属与Cl2、O2等物质直接反应 |
钢铁在潮湿的空气中被腐蚀 |
(2) 金属腐蚀的快慢的判断方法
不纯的金属或合金,在潮湿的空气中形成原电池发生电化腐蚀,活泼金属因被腐蚀而损耗,金属腐蚀的快慢与下列两种因素有关:
a、与构成原电池两极的材料有关。两极材料的活动性差别越大、电动势越大、氧化还原反应的速率越快,活泼金属被腐蚀的速率越快。
b、与金属所接触的电解质强弱有关。活泼金属在电解质溶液中的腐蚀快于非电解质溶液中的腐蚀,在强电解质溶液中的腐蚀快于在弱电解质溶液中的腐蚀。一般说来可用来下列原则判断:
电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护措施的腐蚀
同种金属腐蚀:强电解质>弱电解质>非电解质
☆ 巧思巧解:
1、 原电池、电解池比较
|
|
原电池 |
电解池 |
||||||||||
|
定义 |
 将化学能转变成电能的装置 将化学能转变成电能的装置 |
将电能转变成化学能的装置 |
||||||||||
|
装置 举例 |
|
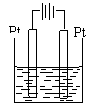
|
||||||||||
|
形成 条件 |
①活动性不同的两个电极; ②同时插入同一电解质溶液; ③用导线相互连接或直接接触组成闭合回路 |
①两电极接直流电源 ②两电极同时插入同一电解质溶液 ③用导线相互连接组成配合回路 |
||||||||||
|
电极 名称 及判断 |
负极:电子流出的极或较活泼的金属电极或发生氧化反应的电极。 正极;电子流入的极或较不活泼的金属电极或发生还原反应的电极。 |
阴极:与电源负极相连的极 阳极:与电源正极相连的极  电极的种类 惰性电极:Pt、Au、石墨等 电极的种类 惰性电极:Pt、Au、石墨等(依材料分) 活性电极:除Pt、Au、石墨外 |
||||||||||
|
反应原理 |
   Zn-2e-=Zn2+ 2H++2e-=H2↑ |
  
 
|
||||||||||
|
电极反应 |
负极:电极本身失电子,发生氧化反应。 正极:电极本身不反应,溶液中的某些离子在正极上获得电子,发生还原反应。 阳离子放电顺(氧化性强弱顺序): Ag+>Hg2+>Fe3+>Cu2+>Pb2+>Sn2+>Fe2+>Zn2+>H+>Al3+>Mg2+>Na+>Ca2+>K+ |
阳极:若为惰性电极,则电极本身不反应,溶液中的阴离子失去电子,发生氧化反应 阴离子放电顺序(还原性强弱顺序):S2―> I―>Br―>Cl―>OH―>含氧酸根 若为活性电极:则电极本身失去电子,发生 氧化反应。 阴极:电极本身不反应,溶液中阳离子在阴 极上获得电子,发生还原反应。 |
||||||||||
|
电子流向 |
  负极
正极 负极
正极 |
电源负极→沿导线→阴极→电解溶液中离子的移动→阳极→沿导线→电源正极 |
26.(9分)2mol丁烷气体与一定量氧气共贮于一固定体积的容器中,压强为7kPa,点火燃烧后回到室温,容器只存在一定量的水(其体积可以忽略不计)和CO、CO2两种气体,总压强为4kPa。求:
(1)生成水的质量;
(2)反应前氧气的物质的量;
(3)反应后气体中CO2和CO的物质的量。
25.(9分)在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
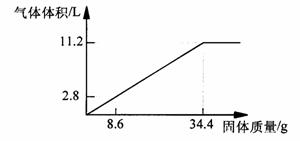
(1)NaOH溶液的物质的量浓度是___________ mol·L-1
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 ____ L(标准状况)
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为____L(标准状况)。
24.(10分)已知
(1) (R和R’代表烃基) RNH2+R’CH2Cl RNHCH2R’
RNHCH2R’
(2)苯的同系物能被高锰酸钾氧化,如: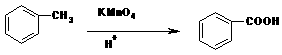
(3) (苯胺,弱碱性,易被氧化)
(苯胺,弱碱性,易被氧化)
化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:


请回答下列问题:
(1)反应⑤的主要产物C中含有___________种官能团(除苯环外)
(2)B物质的结构简式是 ______________________。
(3)反应①②的化学方程式①__________________________②
(4)上列转变过程中属于取代反应的是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com