
题目列表(包括答案和解析)
22.(12分)一定温度下,将3molA气体和lmolB气体通过一密闭容器中,发生如下反应
3A(g)+B(g)  xC(g);△H<0
xC(g);△H<0
请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为O.4mol/L。
①1min内,B的平均反应速率为
②若反应经2min达到平衡,平衡时C的浓度 O.8m01/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是 ;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式 。
(2)若维持容器压强不变
①达到平衡时C的体积分数 22%,(填“大于”、“等于”或“小于”);
②欲使反应达到平衡时C的物质的量是①中平衡的2倍,则起始物质改加 molC即可。
21.(2分)现有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A、D同主族
C、E 同主族,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成
电子总数相等的分子M、N,且N为比较常见的液态化合物。请回答下列问题:
(1)B的简单阴离子的结构示意图 。
(2)A、D、E三种元素组成的化合物电子式为:
(3)①C、D、E对应的简单离子的半径由大到小为 (用离子符号表示)
②写出能证明C和E非金属性强弱的一个化学方程式 。
(4)A、C、E三种元素能形成多种18电子分子,写出其中两种所能发生的反应方程式
(5)标况下,1gD单质在C单质中完全燃烧可放出QKJ热量。则此反应的热化学方程式为
20.(8分)分别取40mL的0 50mol/L盐酸与40mL 0.55mol/L氢氧化钠溶液进行中和反应。
通过测定反应过程中所放出的热量可计算中和热。请回答下列问题。
(1)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、 、 。
(2)为什么中和热测定中要用稍过量的碱(或酸):
(3)假设盐酸和氢氧化钠溶液的密度都是1g/cm3,又知中和后生成溶液的比热容c=4 18J/
(g·℃)。为了计算中和热,某学生实验记录数据如下:
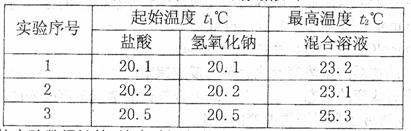
依据该学生的实验数据计算,该实验测得的中和热△H = ; (结果保留一位小数)
(4)上述实验数值结果与中和热的理论值57.3 kJ/mol有偏差,产生偏差的原因可能是(填
字母) 。
a.实验装置保温、隔热效果差 b.量取盐酸与氢氧化钠溶液时仰视读数
c.分多次把Na0H溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定盐酸溶液的温度
19.在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,
下列表述中正确的是
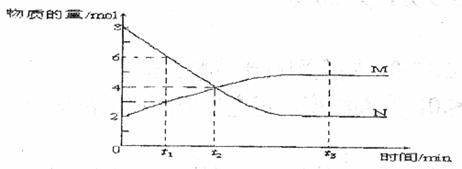
A.反应的化学方程式为:2M  N B.tz时,正逆反应速率相等,达到平衡
N B.tz时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M浓度的2倍
第Ⅱ卷(非选择题,共52分)
18.在一个固定体积的密闭容器中,加入2molA和1molB发生如下反应:
2A(g)+B(g)  3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下
3C(g)+D(g),达到平衡时C的浓度为wmol/L若维持体积和温度不变,按下
列四种方式加入起始量,达平衡后,C仍为wmol/L的是
A、4molA+2molB B、2molA+1molB+3molC+1molD
C、3molC+1molD+1molB D、3molC+1molD
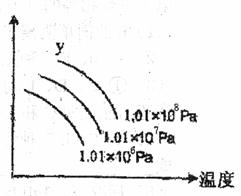
16.右图表示外界温度和压强对反应L(s)+G(g)  2R(g)△H>0的影响,图中Y的意义为
2R(g)△H>0的影响,图中Y的意义为
A.平衡混合气中R的体积分数
B平衡混合气中G的体积分数
C.L的转化率
D.R的产率
17恒温恒压下,在容积可变的器皿中,反应2N02(气)  N204(气)达到平衡后,再向容器内通入一定量N02,又达到平衡时,N204的体积分数
N204(气)达到平衡后,再向容器内通入一定量N02,又达到平衡时,N204的体积分数
A.不变 B.增大 C.减小 D.无法判断
15.反应:A(气)+3B(气)  ±2C(气)△H<0达平衡后,将气体混合物的温度降低
±2C(气)△H<0达平衡后,将气体混合物的温度降低
下列叙述中正确的是
A 正反应速率加大,逆反应速率变小,平衡向正反应方向移动
B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动
C.正反应速率和逆反应速率变小,平衡向正反应方向移动
 D.正反应速率和逆反应速率变小,平衡向逆反虑方向移动
D.正反应速率和逆反应速率变小,平衡向逆反虑方向移动
4.下列事实不能用勒夏特列原理解释的是
A. Kz CrzO7溶液的颜色随溶液的PH变化而变化。
B. 绿色的氯水光照后颜色变浅
C.由H2、Iz蒸气、HI组成的平衡体系加压后颜色变深
D.在含有Fe(SCN)2+的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
13.可逆反应:2N02 2NO+02在密闭容器中反应,达到平衡状态的标志是:
2NO+02在密闭容器中反应,达到平衡状态的标志是:
①单位时间内生成n mol02的同时生成2n molNO2
②单位时间内生成nmol02的同时,生成2nmolNO
@用N02、NO、02的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥ B.②③⑤ C. ①③④ D.①②③④⑤⑥
12.同温同压下,当反应物分解了8%时,总体积也增加8%的是
A. 2NO(g)  N2(g)+02(g) B.2NH3(g)
N2(g)+02(g) B.2NH3(g)  N2(g)+3H2(g)
N2(g)+3H2(g)
C. 2N03 (g)=4N02(g)+O2(g) D.2N02(g) 2NO(g)+02(g)
2NO(g)+02(g)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com