
题目列表(包括答案和解析)
3.下列物质的水溶液中,其pH小于7的是 ( )
A.Na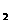 C0
C0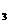 B.NHdN03 C.Na
B.NHdN03 C.Na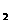 S0
S0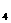 D.KN0
D.KN0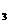
2.哥伦比亚号航天飞机曾用金属铝粉和高氯酸铵(NH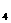 C10
C10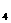 )的混合物作固体燃料。在该固体燃料中,铝元素、氮元素及氯元素的化合价分别是 ( )
)的混合物作固体燃料。在该固体燃料中,铝元素、氮元素及氯元素的化合价分别是 ( )
A.+3、-3、+7 B.0、-3、+7 C.+3、+3、+5 D.O、+1、-1
1.化学反应中的能量变化,通常表现为热量的变化,如Ba(OH)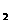 ·8H
·8H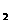 0与NH
0与NH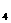 Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是 ( )
Cl的反应要吸收热量,在化学上叫做吸热反应。其原因是 ( )
A.反应物所具有的总能量高于生成物所具有的总能量
B.反应物所具有的总能量低于生成物所具有的总能量
C.在化学反应中需要加热的反应就是吸热反应
D.在化学反应中需要降温的反应就是放热反应
26.(12分)去年,我国南方某省发生了一起严重的“12·11”砒霜泄漏事件。砒霜是三氧化二砷(As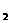 0
0 )的俗名,剧毒。有关方面采用石灰中和等措施,使被污染的河水含砷量降低到国家允许的标准内,消除了这一事件所造成的危害。
)的俗名,剧毒。有关方面采用石灰中和等措施,使被污染的河水含砷量降低到国家允许的标准内,消除了这一事件所造成的危害。
测定砷是利用下述反应: AsO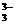 +I
+I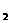 +H
+H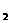 0
0 AsO
AsO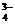 +2I
+2I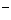 +2H
+2H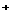
这反应是可逆的,控制溶液的酸碱性,可以测定不同价态(+3或+5)的砷。
今有一试样,含As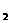 0
0 与As
与As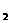 0
0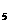 及其他对测定没有影响的杂质。将此试样用NaOH溶液溶解后,在中性溶液中用0.025 00 mol·L
及其他对测定没有影响的杂质。将此试样用NaOH溶液溶解后,在中性溶液中用0.025 00 mol·L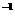 的I
的I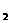 -KI溶液滴定.用去20.00 mL。测定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.150 0 mol·L
-KI溶液滴定.用去20.00 mL。测定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.150 0 mol·L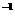 的Na
的Na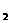 S
S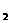 0
0 溶液滴定,用去30.00 mL。试计算试样中As
溶液滴定,用去30.00 mL。试计算试样中As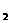 0
0 和As
和As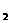 0
0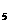 的质量。(已知2Na
的质量。(已知2Na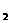 S
S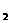 0
0 +I
+I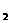
 Na
Na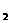 S
S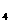 0
0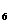 +2NaI)
+2NaI)
25.(7分)将一定量的氧化铜加入到100.0 g质量分数为19.6%的硫酸溶液中,完全溶解后溶液显蓝色,再加入19.6g铁粉充分反应后,经过滤干燥得到的固体仍为19.6g。
(1)通过计算说明干燥后的固体是什么物质?
(2)求原氧化铜的质量。
24.(8分)某有机物A含C 54.8%,H 5.58%,N 7.11%,其余含0,A的相对分子质量不超过300。A是a-氨基酸,分子中不存在甲基(一CH ),能与FeCl
),能与FeCl 溶液发生显色反应,1 mol A最多能与3 mol NaOH完全反应。
溶液发生显色反应,1 mol A最多能与3 mol NaOH完全反应。
请回答:
(1)有机物A的相对分子质量为________,其分子式为_________。
(2)符合上述条件的有机物A的可能结构有________(填数字)种,写出其中的任一种的结构简式__________
23.(8分)百合醛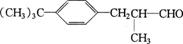 是一种香料,可由异丁基苯经一系列的反应得到,其合成路线如下:
是一种香料,可由异丁基苯经一系列的反应得到,其合成路线如下:
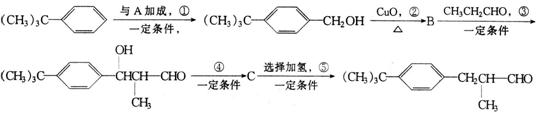
请回答:
(1)写出A和B的结构简式:A_________ ,B_______ _。
(2)反应④的反应类型是 (填有机化学反应类型名称),其化学方程式是:
_____________________________________ _。
22.(10分)铁、铝、碳三种单质的混台物,在适当条件下可以按下面的示意图进行反应。已知图中的各字母分别代表纯净物或混台物。G、H、K、L在室温下都是气体,E是红褐色固体,P是白色固体。
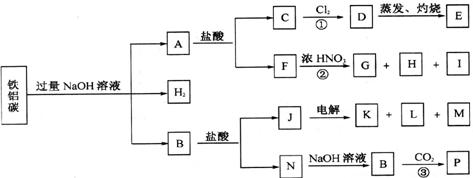
请回答:
(1)E的化学式是______________,M的化学式是_________________________。
(2)反应①的离子方程式是_________________________ 。
(2)反应②的化学方程式是__________________________ 。
(3)反应③的离子方程式是___________________________ 。
21.(10分)某温度(t℃)时,测得0.0l mol·L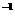 的NaOH溶液的pH为11,则该温度下水的K
的NaOH溶液的pH为11,则该温度下水的K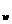 =
。在此温度下,将pH=a的NaOH溶液V
=
。在此温度下,将pH=a的NaOH溶液V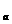 L与pH=b的H
L与pH=b的H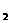 S0
S0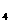 溶液V
溶液V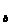 L混合。
L混合。
(1)若所得混合液为中性,且a=12,b=2,则V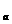 ︰V
︰V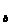 =
;
=
;
(2)若所得混合液为中性,且a+b=12, 则V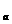 ︰V
︰V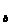 =
;
=
;
(3)若所得混合液的pH=10,且a=12,b=2,则V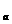 ︰V
︰V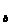 =
。
=
。
20.(13分)已知FeS0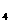 在高温下分解生成Fe
在高温下分解生成Fe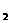 O
O 、S0
、S0 和SO
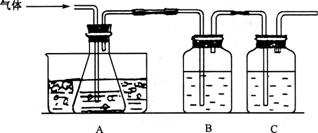
和SO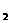 。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0
。某研究性学习小组先用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeS0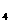 的质量。
的质量。
请回答下列问题:
(1)实验时,A瓶内盛水,水中滴有数滴 溶液,B瓶内盛品红试液,C瓶内盛NaOH溶液,NaOH溶液的作用是________________________________________________。
(2)A瓶内所盛试剂的作用是___________ __,A瓶要用冰水冷却的原因是_________________________________________________________________。
(3)检验后,用A瓶内的混合物测定FeS0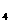 已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
已分解的质量,其实验操作的第一步是(简述操作步骤)____________________________________________________________。
(4)测定过程中,在过滤器上将沉淀洗净后,将沉淀灼烧并冷却至室温,称量其质量为a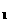 g,再次灼烧冷却至室温称量其质量为a
g,再次灼烧冷却至室温称量其质量为a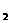 g,且a
g,且a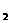 <a
<a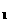 ,接下来的操作应当是_____________________________________________________________
。
,接下来的操作应当是_____________________________________________________________
。
(5)已经分解的FeS0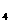 的质量是___________
_(填计算式)。
的质量是___________
_(填计算式)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com