
题目列表(包括答案和解析)
23.(10分)有原子序数依次增大的A、B、C、D、E五种短周期元素,它们可两两组成甲、乙、丙三种化合物,各化合物中原子个数比关系如下表:
|
|
甲 |
乙 |
丙 |
|
化合物中各元素原子个数比 |
A∶C=1∶1 |
D∶E=1∶3 |
B∶E=1∶4 |
其中A、B两种原子的核电荷数之差等于它们的原子最外层电子数之和;B原子最外层电子数比其次外层电子数多2个;在周期表中,C是E的邻族元素,化学性质活泼;D和E位于同一周期,且D和E的原子序数之和为30。
(1)写出A、B、C、D的元素名称:
A、___________B、___________C、___________D、___________
(2)向甲的水溶液中加入MnO2,反应的化学方程式: 。
(3)乙的水溶液呈酸性,与饱和NaHCO3溶液反应会迅速产生大量气体和难溶物,有关离子方程式是 。
(4)向30 mL 1 mol·L-1 KI溶液中依次注入下列试剂:①1 mL 5 mol·L-1盐酸 ②0.5 mol·L-1 30%甲溶液 ③1 mL丙,经充分振荡后,静置,可得一紫色溶液。这种紫色溶液是______________。
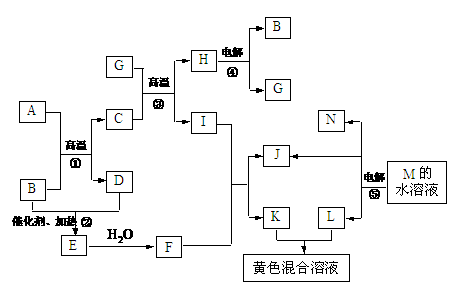
22.(10分)根据反应框图填空,已知反应①-⑤均为工业生产及应用中常见反应,其中B、G、I、J、L均为常见单质,B、J、L为气体。A是工业生产中重要的矿石原料的主要成份,其相对分子质量为120。
(1)写出A、B的化学式
A__________________ B____________________
(2)写出下列化学反应方程式:
反应②的化学方程式_________________________________________________
反应③的化学方程式_________________________________________________
反应⑤的离子方程式_________________________________________________
(3)写出下列反应在工业生产所使用设备的名称
反应①所使用设备的名称_________________________________
21.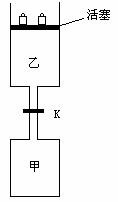 (8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5
mol B,向乙中充入3 mol A、7 mol
B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
(8分)如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5
mol B,向乙中充入3 mol A、7 mol
B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g) C(g)
C(g) +2D(g);ΔH<0
+2D(g);ΔH<0
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
 (3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
(用含V的代数式表示,连通管中气体体积忽略不计。)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为
(用含V的代数式表示,连通管中气体体积忽略不计。)
20.(12分)电镀厂曾采用有氰电镀工艺,由于排放的废水中含有的剧毒CN-离子,而逐渐被无氰电镀工艺替代。处理有氰电镀的废水时,可在催化剂TiO2作用下,先用NaClO将CN-离子氧化成CNO-,再在酸性条件下继续被NaClO氧化成N2和CO2。环保工作人员在密闭系统中用下图装置进行实验,以证明处理方法的有效性,并测定CN-被处理的百分率。
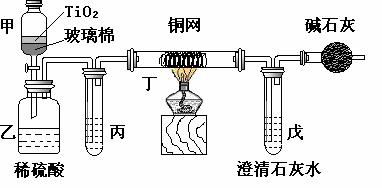
将浓缩后含CN-离子的污水与过量NaClO溶液的混合液200 mL(其中CN-的浓度为0.05 mol·L-1)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。
(1) 甲中反应的离子方程式为
乙中反应的离子方程式为
(2) 乙中生成的气体除N2和CO2外,还有HCl及副产物Cl2等,上述实验是通过测定二氧化碳的量来确定对CN-的处理效果。
丙中加入的除杂试剂是 (填字母)
a.饱和食盐水 b.饱和NaHCO3溶液
c.浓NaOH溶液 d.浓硫酸
(3)丁在实验中的作用是
(4)戊中盛有足量的石灰水,若实验中戊中共生成0.82 g沉淀,则该实验中测得CN-被处理的百分率等于 。请说明该测得值与实际处理的百分率相比偏高还是偏低?简要说明理由____________________________________________________________________________。
19.(10分)回答下列问题:
(1)下列仪器中:①普通漏斗 ②天平 ③蒸馏烧瓶 ④容量瓶 ⑤燃烧匙 ⑥滴定管 ⑦分液漏斗,常用于物质分离的是__________(填编号),其中根据物质沸点不同分离物质的仪器是______________(填编号)。
(2)实验室有贮存以下物质的方法:A少量白磷贮存在水中;B碳酸钠溶液贮存在带玻璃塞的玻璃瓶中;C少量金属钠贮存在酒精中;D浓硝酸贮存在棕色的细口玻璃瓶中。其中正确的_______________________(填编号)。
(3)下列实验操作错误的是___________
A.检测溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡进行比较。
B.容量瓶检漏的操作是:在容量瓶中注入适量的水,塞上玻璃瓶塞,左手五指托住瓶底,右手食指顶住瓶塞,反复倒置,观察是否漏水。
C.用酸滴定碱的操作是:左手摇动锥形瓶,右手控制活塞,两眼注视溶液液面颜色的变化。
D.观察钾元素焰色反应的操作是:将铂丝放在稀盐酸中洗涤,然后蘸取固体氯化钾,置于煤气灯的火焰上进行灼烧,透过蓝色钴玻璃进行观察。
18.常温下用石墨电极,电解100 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L-1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L时,假设溶液体积不变,下列说法正确的是
A.阴极增重1.4 g B.所得溶液 pH<1
C.阴极增重0.64 g D.所得溶液pH>1
第II卷(非选择题,共78分)
17.在一定体积某浓度的Ba(NO3)2溶液中,逐滴加入pH=1的稀硫酸至溶液中的Ba2+恰好完全沉淀时,测得溶液pH=2,若忽略两溶液混合时的体积变化,则稀硫酸的体积与Ba(NO3)2溶液的体积比是
A.10∶1 B.1∶10 C.9∶1 D. 1∶9
16.某盐酸的浓度为12.0 mol·L-1,其密度为1.19 g·cm-3。现有该浓度的盐酸100 m3,则用于吸收HCl形成该盐酸的水的体积是
A.75.2 m3 B.85.5 m3 C.90.8 m3 D.100 m3
15.在0.1 mol·L-1的Na2CO3溶液中,下列关系正确的是
A.c(Na+)> c(CO32-)> c(HCO3-)> c(OH-)> c(H+) B.c(Na+)> c(CO32-)> c(OH-)> c(HCO3-)> c(H+)
C.c(Na+)+ c(H+)= c(OH-)+c(CO32-)+ c(HCO3-) D.c(OH-)= c(H+)+ c(HCO3-)+2c(H2CO3)
14.设N0为阿伏加德罗常数的值,下述错误的是
A.4 g氦气所含原子个数为N0 B.18 g水含有8 N0个电子
C.16 g氧气和16 g臭氧所含的原子数均为N0 D.12 g金属镁变为镁离子时,失去的电子数目为N0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com