
题目列表(包括答案和解析)
2.Al(OH)3的两性
在溶液中同时发生酸式电离和碱式电离.
Al(OH)3  H3AlO3
H3AlO3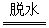 HAlO2+H2O
HAlO2+H2O

Al3++3OH- AlO-2+H+
若向此溶液中加入酸,因H+与OH-结合生成水,反应向碱式电离方向进行,此时Al(OH)3是碱性,若加入碱,因OH-与H+结合生成水,故向酸式电离方向进行,这时Al(OH)3显酸性.
Al(OH)3溶解度很小,无论酸式或碱式电离的程度都很小,其碱性略强于酸性,故仍属于弱碱.
1.铝与强碱溶液反应的实质
反应过程:
2×3e

2Al+6H2O 2Al(OH)3↓+3H2↑
2Al(OH)3↓+3H2↑
2Al(OH)3+2NaOH 2NaAlO2+4H2O
2NaAlO2+4H2O
2×3e

总反应式: 2Al+2H2O+2NaOH  2NaAlO2+3H2↑
2NaAlO2+3H2↑
Al与水很难反应,且生成的Al(OH)3附在Al的表面,阻止了Al继续反应,但强碱NaOH能溶 解Al(OH)3,故可促使Al与强碱液反应,而弱碱如氨水,不溶解Al(OH)3,故Al在弱碱溶 液中不反应.
3.受热分解
Mg(OH)2  MgO+H2O
MgO+H2O
2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
实验室制法
可溶性镁盐加NaOH溶液 Mg2++2OH-  Mg(OH)2↓
Mg(OH)2↓
可溶性铝盐加氨水 Al3++3NH3·H2O Al(OH)3↓+3NH+4
Al(OH)3↓+3NH+4
2.跟碱反应
Al(OH)3+OH- AlO-2+2H2O
AlO-2+2H2O
1.跟酸反应
Mg(OH)2+2H+ Mg2++2H2O(可溶于NH4Cl等强酸弱碱盐)
Mg2++2H2O(可溶于NH4Cl等强酸弱碱盐)
Al(OH)3+3H+  Al3++3H2O
Al3++3H2O
4.镁和铝的氢氧化物的主要性质
Mg(OH)2(中强碱) Al(OH)3(两性氢氧化物)
物理性质
白色粉末难溶于水 白色固体,难溶于水
化学性质
3.跟碱反应
Al2O3+2OH-  AlO-2+2H2O
AlO-2+2H2O
2.跟酸反应
MgO+2H+ Mg2++H2O
Mg2++H2O
Al2O3+6H+ 2Al3++3H2O
2Al3++3H2O
1.跟水的反应
MgO+H2O=Mg(OH)2(反应缓慢进行)
3.镁和铝的氧化物的主要性质
MgO(碱性氧化物) Al2O3(两性氧化物)
物理性质
白色粉末、熔点高 白色固体、熔点高
化学性质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com