
题目列表(包括答案和解析)
9、若在加入铝粉能放出氢气的溶液中,下列各组离子可能共存的是 ( )
(A) NH4+、NO3-、CO32-、Na+ (B) Na+、Ba2+、Mg2+、HCO3-
(C) NO3- 、Na+、K+、Cl- (D) NO3-、 K+、 AlO2-、OH-
8、下列叙述正确的是 ( )
(A) 固体氯化钠不导电,所以氯化钠是非电解质
(B) 铜丝能导电,所以铜是电解质
(C) 氯化氢水溶液能导电,所以氯化氢是电解质
(D) 五氧化二磷溶于水能导电,所以五氧化二磷是电解质
7、 在密闭容器中发生以下反应:aX(g)+bY(g) cZ(g)+dW(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
在密闭容器中发生以下反应:aX(g)+bY(g) cZ(g)+dW(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达平衡时,W的浓度为原平衡的1.8倍,下列叙述正确的是 ( )
(A) 平衡正向移动 (B) a + b > c + d
(C) Z的体积分数变大 (D) X的转化率变小
6、下列有关合成氨工业叙述可用勒夏特列原理来解释的是 ( )
(A) 使用铁触煤,使N2和H2混合气体有利于合成氨
(B) 高压比常压更有利于合成氨
(C) 500℃左右比室温更有利于合成氨
(D) 合成氨时采用循环操作,可提高原料的利用率。
1,工业冶炼钨采取的方法是( )
(A) 热分解法 (B) 还原法
(C) 电解法 (D) 自然界存在直接得到
2,某些化学试剂可用于净水,水处理中使用的一种无机高分子混凝剂的化学式表示为[Al2(OH)nClm·yH2O]x,式中m等于( )
(A) 3-n (B) 6-n (C) 6+n (D) 3+n
3,下列反应的离子方程式正确的是 ( )
(A) 硫酸铝溶液与氢氧化钡溶液: Fe3+ + 3OH- == Fe(OH)3↓
(B) 硫化钠溶液与氯化钡溶液: 2Fe3+ + 3S2- == Fe2S3
(C) 过量的铁与很稀的硝酸溶液反应无气体放出:
4Fe + 10H+ + NO3- == 4Fe2+ + 3H2O + NH4+
(D) 硫化氢气体通入氯化亚铁溶液: H2S + Fe2+ == FeS↓+2H+
4,下列反应原理不符合工业冶炼金属实际情况的是( )
(A) 2HgO====2Hg+O2 (B) 4Al+3MnO2====2Al2O3+3Mn
(C) 2MgO====2Mg+O2 (D) 4CO+Fe3O4====3Fe+4CO2
5、用铁片与稀H2SO4反应制取H2 时,下列措施不能使H2速率加快的是 ( )
(A) 对反应的体系进行加热 (B) 将稀H2SO4改用98%的浓H2SO4
(C) 滴加少量的CuSO4溶液 (D) 不用铁片,改用铁粉
15.1.92g Cu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672ml气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 ( )
A.504 mL B.336 mL C.224 mL D.168 mL
高三年级第四次月考化学试卷
14.纳米材料的表面粒子占总粒子数比例极大,这是它有许多特殊性质的主要原因。假设某纳米颗粒的大小和结构恰好与氯化钠晶胞(最小结构单元)相同(如右图所示),则这种纳米颗粒的表面粒子数与总粒子数的比值为( )
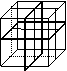 A、7:8 B、13:14 C、25:26 D、26:27
A、7:8 B、13:14 C、25:26 D、26:27
13.在氯化铁和氯化铝的混合溶液中,先加入过量的碘化钾溶液,再加入足量的硫化钠溶液,所得沉淀是( )
A、Al2S3和I2 B、Fe(OH)3和Al(OH)3
C、Fe2S3和I2 D、FeS、Al(OH)3和S
12.酸根RO3―所含的电子数比硝酸根NO3―的电子数多10,则下列说话正确的是( )
A、R原子的电子层数比N的电子层数少1
B、RO3―中R的化合价与NO3―中N的化合价相等
C、RO3―和NO3―只能被还原,不能被氧化
D、R和N为同族元素
11.一种化学冰袋中含有Na2SO4·10H2O和NH4NO3,用时将它们混合并用手搓揉就可致冷,且致冷效果能维持一段时间。以下关于其致冷原因的推猜测肯定错误的是( )
A、Na2SO4·10H2O脱水是吸热过程
B、较长时间致冷是由于Na2SO4·10H2O脱水是较慢的过程
C、铵盐在该条件下发生复分解反应是吸热反应
D、NH4NO3溶于水会吸收热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com