
题目列表(包括答案和解析)
23.(8分)
(1)NaCl (2)A中必含有NaCl
(3)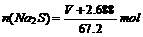 (4)2.56 g(每空4分,共16分)
(4)2.56 g(每空4分,共16分)
24.(10分)白色粉末A由Na2S、Na2SO3、Na2S2O3、Na2SO4、NaCl等物质中的三种混合而成,取一定量A样品投入100 mL、2.2 mL·L-1盐酸中,充分反应后过滤,最终得到100 mL pH为0的溶液。将此溶液蒸干,只得到8.19 g纯净B。
(1)B的化学式为_______________________________。
(2)请通过计算推断A中是否有NaCl?____________________________________。
(3)若反应中还生成V L(标准状况)气体,且气体不会使品红溶液褪色,则取出的A样品中含有Na2S___________________________mol(用含V的代数式表示)。
(4)A中组成的物质的量比不同时,所产生的沉淀的量也不同,上述A样品与盐酸反应可生成沉淀的质量最大值是_____________ g。
23.(13分)其他正确结果参照本标准给分 (2)常压时SO2的转化率已经很大,增大压强会增加动力成本和设备成本(2分);压强一定时,温度升高SO2转化率下降(3分)(3)6.23×105 kJ(3分)(4)V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ( 0.46 )∶( 6.5)∶ (7.7 )∶82(3分)
23.(8分)硫酸工业生产应考虑综合经济效益。
(1)工业生产硫酸的原料气成分(体积分数)为:SO2 7%,O2 11%,N2 82%。
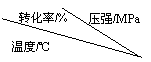 压强及温度对SO2转化率的影响如下:
压强及温度对SO2转化率的影响如下:
|
|
0.1 |
0.5 |
1 |
10 |
|
400 |
99.2 |
99.6 |
99.7 |
99.9 |
|
500 |
93.5 |
96.9 |
97.8 |
99.3 |
|
600 |
73.7 |
85.8 |
89.5 |
96.4 |
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是
____________________________________________________________________。
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是____________________________________________________________________。
(2)据测算,接触法制硫酸过程中,每生产1 t 98%的硫酸需消耗3.60×105 kJ能量。
若反应:2SO2(g)+O2(g) 2SO3(g),ΔH=-196.6 kJ /mol放出的热量完全被利
用,则每生产1 t 98%的硫酸可为外界提供_____________kJ能量(不考虑其他过
程释放的能量)。
(3)依据题给数据计算:在500℃0.1MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶82
(结果保留两位有效数字)。
22.(1)(4分)①酯化(取代)②取代 ③水解(取代)④取代
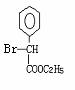
(2)(2分)
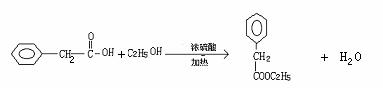
(3)
①(2分)
③(2分)
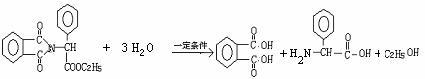
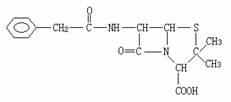
22.(10分)青霉素(C16H18N2O4S)的结构简式为:
它是人们经常使用的一种抗生素,但是经过多年的
使用,不少病菌对青霉素产生了抗药性,为此科学
家又研制了一种新的青霉素--氨苄青霉素来代替
青霉素。下图是由青霉素制取氨苄青霉素的合成路线:
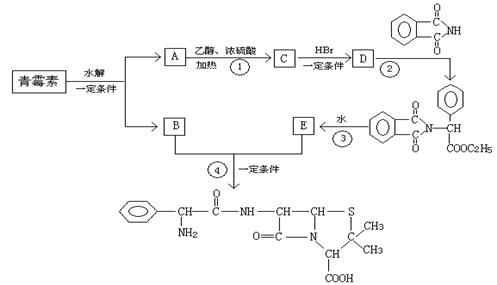
已知:有机物分子中和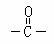 相连的碳原子称为α-碳原子,其上面连着的氢原子称为α-氢原子,在一定条件下,α-氢原子易被取代。请回答下列问题:
相连的碳原子称为α-碳原子,其上面连着的氢原子称为α-氢原子,在一定条件下,α-氢原子易被取代。请回答下列问题:
(1)写出反应①②③④的反应类型:
① ; ② ;③ ; ④ 。
(2)写出D的结构简式 。
(3)写出反应①、③的化学方程式
① ;
③ 。
21.(1)HCHO (2分);CH3CH2CHO (2分)
(2)消去;加成;消去 (3分)
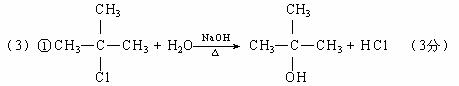
② 3 (3分)
21.(8分)醛可以发生分子间的反应,生成羟基醇。如:
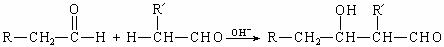
Ⅰ.根据上述信息,回答下列问题:
(1)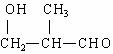 可由
与
两种醛合成。
可由
与
两种醛合成。
(2)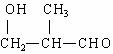 转化为
转化为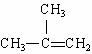 须依次经过 、
、
须依次经过 、
、
等较为合理的反应过程(填写反应类型名称)。
Ⅱ.已知烯烃在发生加成反应时,加成试剂中的氢总是加在含氢较多的不饱和碳上。
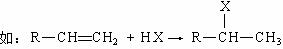
回答问题:
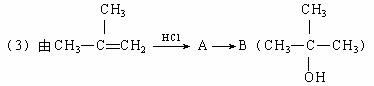
①写出A→B反应的化学方程式: (应注明反应条件)。
②A的同分异构体(不包括A)共有 种。
20.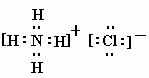 (10分)⑴ Mg(OH)2
(每空2分)
(10分)⑴ Mg(OH)2
(每空2分)
⑵4Fe(OH)2+O2+2H2O=4Fe(OH)3 (2分)
⑶ Ag(NH3)2++2H++Cl-=2NH4++AgCl↓(2分)
⑷C为固体,X为浓溶液 无氧(每空1分)
20.(12分)下图中,A为气体非金属单质,D是空气中含量最多的气体,B、E、Z为无色氢化物,其中B、E为有刺激性气味的气体,C是由三种短周期非金属元素组成的离子化合物,F、I、L为白色沉淀,其中F不溶于稀硝酸,N、P是金属单质;反应②在E的浓溶液中进行,反应⑦在E的稀溶液中进行,反应②、⑦均可用于实验室制取某种气体(图中部分反应物和生成物没有列出)。
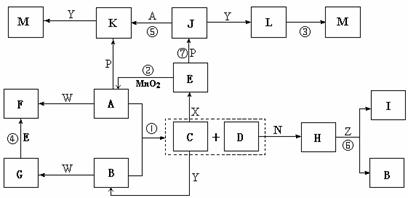
请按要求回答:
⑴写出C的电子式 ,I的化学式 ;
⑵反应③的化学方程式为 ;
⑶反应④的离子方程式为 ;
⑷由C制取E时反应物的状态是 ,由J制取L时反应的环境是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com