
题目列表(包括答案和解析)
28.(13分)乙醛是重要的化工原料和化学试剂。实验室可用乙醇制乙醛,工业上目前使用两种方法制取乙醛:(1) 乙炔水化法 (2) 乙烯氧化法。两种制法制乙醛的有关信息见下表:
|
物质 项目 |
乙炔水化法 |
乙烯氧化法 |
|
原料 |
乙炔、水 |
乙烯、空气 |
|
反应条件 |
HgSO4、100℃-125℃ |
PdCl2-CuCl2 100℃-125℃ |
|
平衡转化率 |
乙炔转化率 90% |
乙烯转化率 80% |
|
日产量 |
2.5t(某设备条件下) |
3.6t(相同设备条件下) |
|
原料来源生产工艺 |
CaCO3 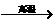 CaO CaO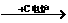 CaC2 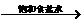 C2H2 C2H2 |
石油裂解气 |
(1) 写出下列化学方程式:
实验室乙醇制乙醛__________________________________________________
乙炔水化法制乙醛__________________________________________________
(2) 将乙醛滴入新制的氢氧化铜悬浊液并加热,其现象是____________________________,反应的化学方程式为_____________________________________________。
(3) 比较两种乙醛的工业制法,从化学反应速率的角度分析,在相同的条件下,较快的是__________(填字母)
(A) 乙炔水化法 (B) 乙烯氧化法
(4)乙烯由石油裂化气进一步催化裂解而来。裂解气中各成分的体积百分含量分别为:甲烷5%、乙烯40%、丙烯10%、丁二烯7%、硫化氢2%、氢气36%。如将上述裂解气通入溴水中,观察到的现象为__________________________________________。经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为____________(精确到0.1)。
(5) 现代工业上乙烯氧化法有逐步取代乙炔水化法的趋势,试通过表中提供的信息,说出其中的两个原因:_________________________________、____________________________
27.(7分)我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
①已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。写出偏二甲(基)肼分子的化学式和结构简式:化学式 ,结构简式 。
②在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中所有的氮元素均转化为N2) 。
26.(10分)已知-NH3连在苯环上显碱性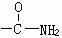 连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
连在苯环上显中性,化学式为C7H7NO2的有机物中其分子结构中有一个苯环,两个侧链(间位),符合下列条件的结构简式为:
(1)既有酸性又有碱性 ;
(2)只有酸性 ;
(3)只有碱性 ;
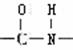 (4)显中性
。
(4)显中性
。
(5)由于-COOH能跟-NH2形成 ,所以可用乙二醇、对苯二甲酸跟上述既显酸性又显碱性的物质发生反应,生成高分子化合物[(C17H13NO5)]n。该化合物为高强度纤维材料,其结构简式为 。
25.(12分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
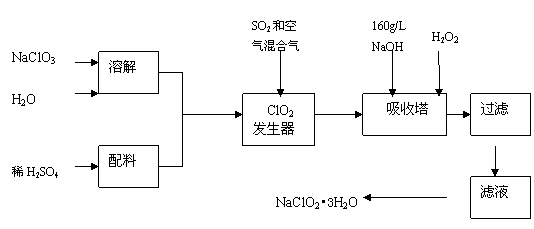

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,
还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
(a)将SO2氧化成SO3,增强酸性; (b)稀释ClO2以防止爆炸;
(c)将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2分解的化学方程式
。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是
否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
(a) Na2O2 (b) Na2S (c)FeCl2 (d)PbO(悬浊液)
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
24.(7分)在密闭容器中,通入AmolN2和BmolH2,在一定条件下达到平衡,容器中还剩余CmolN2,
(1)生成NH3的物质的量为 ; (2)平衡时H2的转化率为 ;
(3)若把容器体积减小一半,则正反应速率 ,逆反应速率 ,
N2转化率 。(填“变大”、“变小”、“不变”)
22.(12分)Ⅰ.中学课本中介绍了如下实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。
请你评价若用上述方法制取乙醛存在哪些不足:
_____________________________________________________________________
Ⅱ.课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:
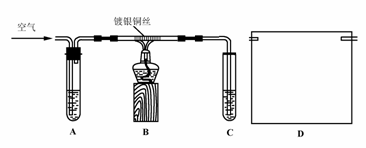
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1分钟后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是________反应(填“放热”或“吸热”),该反应的化学方程式为______________________________________________________;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是:________________________________________________________;
Ⅲ.课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将甲装置浸在70-80℃的水浴中,目的是____________________________;
②装置B、C之间接上丁装置,请你在上面方框中,画出D的装置图。
(4)如果在装置B、C之间不增加D装置,提出你对实验改进的意见:____________。
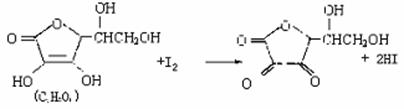 23.(11分)维生素C(C6H8O6)(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汗中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
23.(11分)维生素C(C6H8O6)(水溶液呈酸性)具有明显的抗衰老作用,但易被空气氧化。新鲜水果蔬菜、乳制品中都富含维生素C。如新鲜橙汗中维生素C的含量在500mg/L左右。某课外小组利用碘滴定法测某橙法中维生素C的含量,其反应原理为:
(1)下列说法中正确的是( )
A.上述反应为取代反应 B.滴定时可用淀粉溶液作批示剂
C.滴定时可用甲基橙作指示剂 D.锥形瓶不能用待测橙汁润洗
(2)上述实验前要配制7.50×10-3mol/L的标准碘溶液100mL。除玻璃棒外,还需要的玻璃仪器有 等(填编号)
A.容量瓶 B.烧杯 C.维形瓶 D.烧瓶
(3)标准碘液放入 (填仪器名称),滴定时,眼睛注视 ,直到滴定终点。滴定至终点的现象是 。
(4)滴定过程中能否剧烈摇动锥形瓶 (填能或不能),为什么
。
(5)若经数据处理,滴定中消耗的标准碘溶液的体积是15.00mL,锥形瓶中注入的待测橙汁是20.00mL,则此橙汁中维生素C的含量是 mg/L该橙汁 (填“是”或“不是”)纯天然的新鲜橙汁
21.(8分)今有①CH3COOH、②HCl、③H2SO4三种溶液,用序号回答下列问题
(1)当它们pH相同时,其物质的量浓度由大到小排列是 。
(2)当它们的物质的量浓度相同时,其pH由大到小排列是 。
(3)中和同一烧碱溶液,需同浓度的三种酸溶液的体积关系为 。
(4)体积和浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液恰好完全反应,反需烧碱溶液的体积关系为 。
20.2005年9月始,“禽流感”在全球部分地区爆发,引起了人们继“非典型性肺炎”之后的世界范围内的恐慌。做好环境消毒是预防“禽流感”的重要措施,常用的消毒剂是ClO2或Cl2等的稀溶液,其中ClO2溶液的消毒效果较好。已知ClO2常温下呈气态,其分子构型与水分子的分子构型相似,在自然环境中ClO2最终变为Cl-,下列有关说法中正确的是 ( )
A.ClO2的分子结构呈V型,属非极性分子
B.ClO2中氯元素显+4价,具有很强的氧化性,其消毒效率(以1 mol物质得电子的数目表示)是Cl2的5倍
C.ClO2、Cl2的稀溶液用于环境消毒,具有广谱高效的特点,对人畜无任何危害
D.常用Na2SO3在H2SO4的酸性条件下,还原NaClO3来制ClO2,这一反应的化学方程式可表示为Na2SO3 + 2NaCl3 + H2SO4= 2Na2SO4 + 2ClO2↑+ H2O
第二卷 非选择题(共80分)
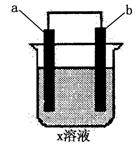
19.下列对如图所示装置实验现象的描述正确的是 ( )
|
|
b电极 |
a电极 |
x溶液 |
实验现象 |
|
A |
石墨 |
石墨 |
CuCl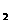 |
a极质量增加,b极放出无色气体 |
|
B |
Fe |
石墨 |
KNO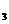 |
a极质量增加,b极放出无色气体 |
|
C |
Fe |
Cu |
CuSO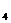 |
a极质量增加,b极质量减少 |
|
D |
石墨 |
石墨 |
HCl |
a、b极都放出无色气体 |
18.甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是:
 (CH3)2C=O + HCN
(CH3)2 C(OH)CN
(CH3)2C=O + HCN
(CH3)2 C(OH)CN
 (CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C (CH3)COOCH3
+ NH4HSO4
(CH3)2C(OH)CN + CH3OH + H2SO4 CH2=C (CH3)COOCH3
+ NH4HSO4
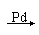 90年代新法的反应是:CH3C≡CH + CO + CH3OH CH2=C (CH3)COOCH3与旧法比较,新法的优点是: ( )
90年代新法的反应是:CH3C≡CH + CO + CH3OH CH2=C (CH3)COOCH3与旧法比较,新法的优点是: ( )
A.原料无爆炸危险 B.原料都是无毒物质
C.没有副产物,原料利用率高 D.对设备腐蚀性较小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com