
题目列表(包括答案和解析)
18.(6分)X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外电子数之和为17。请回答下列问题:
(1)Y、Z和W是否位于同一周期(填“是”或“否”)? ▲ ,理由是 ▲ ;
(2)Y是 ▲ 、Z是 ▲ 、W是 ▲ ;
(3)X、Y、Z和W可组成一种化合物,其原子个数比为8∶2∶4∶1,写出该化合物的化学式 ▲ 。
17.(6分)人们对酸碱的认识已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式
▲ ;
(2)1923年丹麦化学家布朗斯特(Brφusted)和英国化学家劳莱(Lowry)提出了酸碱质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。按酸碱质子理论,下列粒子在水溶液既可看作酸又可看作碱的是 ▲ (填编号);
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]-  H∶OH
H∶OH
试指出下列两个反应中的酸或碱
① H3BO3 + H2O = H+ + B(OH)4- 该反应中的碱是 ▲ (填:H3BO3 或 H2O),
② NaH + H2O = NaOH +H2↑ 该反应中的酸是 ▲ (填:NaH 或 H2O)。
16.往含0.2mol NaOH和0.1mol Ca(OH)2的溶液中持续稳定地通入CO2气体,当通入气体的体积为6.72L(S.T.P)时立即停止,则在这一过程中,溶液中离子数目和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)
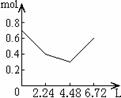
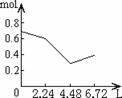
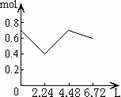
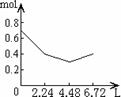
A B C D
第Ⅱ卷(非选择题,共60分)
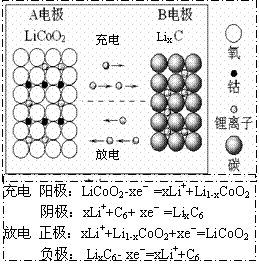
15.锂离子电池主要利用碳的还原和氧化进行工作,比传统的镉镍电池、氢镍电池性能更优越(如右图)。则下列叙述正确的是
① 充电过程中,B极被氧化
 ② 该电池充放电的总反应式为:
② 该电池充放电的总反应式为:
LiCoO2+C6 Li1-xCoO2+LixC6
③ 放电时A极是负极,Li发生还原反应
④ 放电时B极是负极,C6X-发生氧化反应
A.①② B.①③ C.②③ D.②④
14.下列离子方程式书写正确的是
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液
Ca2+ + 2HCO3- + 2OH-== CaCO3↓+ 2H2O + CO32-
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全
Ba2+ + OH- + H+ + SO42- == BaSO4↓+ H2O
C.向Ca(ClO)2溶液中通入适量SO2气体
Ca2+ + 2ClO- + SO2 + H2O == CaSO3↓+ 2HClO
 D.向FeI2溶液中加少量氯水
D.向FeI2溶液中加少量氯水
2Fe2+ + Cl2 == 2Fe3+ + 2Cl-
13.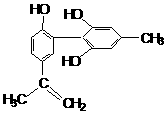 我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法中正确的是
我国支持“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如右图所示,有关该物质的说法中正确的是
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.1 mol该物质分别与浓溴水和H2反应时最多消耗Br2和H2分别为4 mol和7 mol
C.该分子中的所有碳原子不可能共平面
D.滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中存在碳碳双键
11.电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO 等杂质,不符合电解要求,常采用下列步骤除杂:①
加入过量的Na2CO3溶液; ②
加入过量的NaOH溶液;③ 加入过量的BaCl2溶液;④
过滤除去沉淀;⑤ 在溶液中加盐酸调节溶液pH;⑥ 通过阳离子交换塔得精制盐水。下列除杂顺序正确的是
等杂质,不符合电解要求,常采用下列步骤除杂:①
加入过量的Na2CO3溶液; ②
加入过量的NaOH溶液;③ 加入过量的BaCl2溶液;④
过滤除去沉淀;⑤ 在溶液中加盐酸调节溶液pH;⑥ 通过阳离子交换塔得精制盐水。下列除杂顺序正确的是
A.①②③④⑤⑥ B.②③④①⑤⑥ C.③①②④⑤⑥ D.①③④②⑤⑥
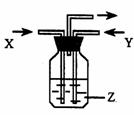 12.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如右图所示),一定没有沉淀生成的是
12.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中(如右图所示),一定没有沉淀生成的是
|
|
X |
Y |
Z |
|
A |
NO2 |
SO2 |
BaCl2 |
|
B |
NH3 |
O2 |
Al2(SO4)3 |
|
C |
NH3 |
CO2 |
CaCl2 |
|
D |
CO2 |
SO2 |
CaCl2 |
10.有机物A和B只由C、H、O三元素中的2种或3种组成,相同物质的量的A和B分别燃烧时消耗相同物质的量的氧气。则A和B的相对分子质量的差值不可能是(n为小于5的正整数)
A.0 B.14n C.18n D.44n
9.将KCl和CrCl3两种固体混合物共熔制得化合物X,X由K、Cl、Cr元素组成。将1.892g
X中Cr元素全部氧化成Cr2O72-, Cr2O72-可过量的KI中氧化出2.667g I2,反应的离子方程式是:Cr2O72-+6I-+14H+=2Cr3++3 I2+7H2O,如果取溶有1.892g X的溶液,加入过量的AgNO3,可得4.52g白色沉淀,则表示X组成的化学式为
A.K3Cr2Cl7 B.K3Cr2Cl5 C.K3Cr2Cl9 D.K2CrCl4
8.足量浓H2SO4与m g铜完全反应,得到的SO2气体的体积为 n L(20℃,1.01×105Pa),则被还原的硫酸是
A.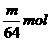 B.
B.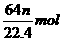 C.
C.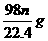 D.
D.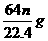
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com