
题目列表(包括答案和解析)
31.电子工业常用一定浓度的FeCl3溶液腐蚀表面有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔绝缘板浸入800 mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入一定量的铁粉,充分反应后,仍有固体存在,将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00 mL,向其中滴入3.00 mol/L AgNO3溶液60.00 mL,溶液中的Cl-恰好完全沉淀。
(1)写出FeCl3溶液腐蚀表面有铜箔的绝缘板的化学方程式:
。
(2)溶液A中FeCl3的物质的量浓度为 mol/L。
(3)假如铁粉不再溶解,向溶液B中加入铁粉的质量至少应大于 g。
(4)若已知将表面有铜箔的绝缘板浸入800 mL某FeCl3溶液A中,溶解铜的32.0g,在反应后的溶液中加入铁粉x mol,随着铁粉的加入,析出铜为 y mol,请建立y和x的函数关系。
(5)根据(4)中的函数关系作图。
30.将12.6 g无水亚硫酸钠固体加入100 mL 8 mol/L 的硫酸中以制取SO2气体,反应完全后,若部分SO2气体溶解在溶液中,溶液中含+4价硫元素的物质的总浓度为0.2 mol/L, 假定溶液的体积不变,忽略容器及导管中气体的体积,求:
(1)得到的产物中硫酸钠的物质的量?
(2)溶液中硫元素的质量?
(3)收集到SO2气体的体积(标准状态下)为多少毫升?
29.有机物A为茉莉香型香料。
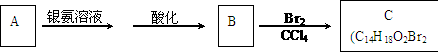
(1)A分子中含氧官能团的的名称是 。
(2)C的分子结构可表示为(其中R和Rノ代表不同的烃基)
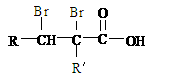
A的化学式是 ,A可以发生的反应是 (填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机物R′-OH为类别属于 。
(4)A分子结构中只有一个甲基,A的结构简式是 。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有 种。
28.松油醇是一种调香香精,它是α、β、γ三种同分异构体组成的混合物,可由松节油分馏产品A经下列反应制得:


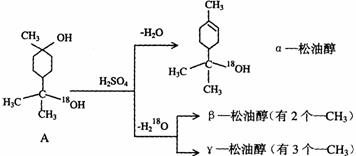
(1)α-松油醇的分子式
(2)α-松油醇所属的有机物类别是 (填序号)
A、醇 B、酚 C、醛 D、酯
(3)由A生成α-松油醇发生的反应类型属 反应(填序号)
A、加成 B、水解 C、消去 D、取代
(4)α-松油醇使溴水褪色的化学反应方程式为:
。
(5)写结构简式:β-松油醇 ,γ松油醇 。
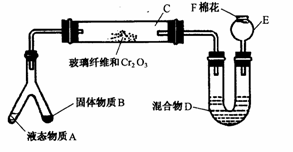
27.微型化学实验(简称ML)是绿色化学新理念在中学化学实验中的应用。微型实验具装置小巧,节约药品,操作简便,现象明显,安全可靠,减少污染等特点。下图是某同学设计的NH3的催化氧化(附着在玻璃纤维上的Cr2O3作催化剂),并检验反应生成的酸性物质的微型装置(图中必要的铁架、铁夹、微型酒精灯等均已略去)。实验可提供的药品有:① NH4Cl、Ca(OH)2的混合物;② 浓氨水;③ KClO3和MnO2;④ 蒸馏水;⑤0.5 mol/LNaOH溶液;⑥ 酚酞试液;⑦ 浓H2SO4;⑧ 6 mol/LNaOH溶液 。试回答下列问题:
(1)微型叉形管中液态物质A是 ,B是 。
(2)C处发生的化学反应方程式是 。
(3)混合物D是为了检验酸性物质的生成而放入的,其组成是 ,
。实验过程中是D变化现象为 。
(4)F处的棉花应蘸取的物质是 。
26.海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
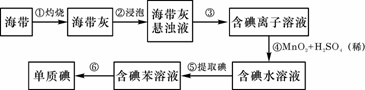
请填写下列空白:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 。
(3)步骤④反应的离子方程式是 。
(4)步骤⑤中,某学生选择用苯来提取碘的理由是 。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法: 。
25.在一容积为2升的密闭容器内加入0.2 mol的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2 + 3H2
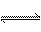 2NH3(g )+ Q(Q﹥0)反应中NH3的物质的量浓度的变化的情况如下图:
2NH3(g )+ Q(Q﹥0)反应中NH3的物质的量浓度的变化的情况如下图:
(1)根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)为 。
(2)该反应的化学平衡常数表达式为 。
 (3)反应达到平衡后,第5分钟时,
(3)反应达到平衡后,第5分钟时,
保持其它条件不变,若改变反应
温度,则NH3的物质的量浓度不
可能为 (填序号) 。
A、0.20 mol/L B、0.16 mol/L C、0.10 mol/L D、0.05 mol/L
(4)反应达到平衡后,第5分钟时,保持其它条件不变,若只把容器的体积缩小一半,平衡 移动(填“向左”、“向右”或“不”),化学平衡常数K (填“增大”、“减小”或“不变”。
(5)若在第8分钟达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟到此平衡时NH3浓度的变化曲线。
24.2001年1月6日,我国525名两院院士投票评选出1999年中国十大科技进步奖,其中第二条是:储氢纳米碳管研究获重大进展。电弧法合成的碳纳米管,常伴有大量杂质--纳米颗粒。这种碳纳米颗粒可借氧化气法提纯。其反应式是:

 C+ K2Cr2O7+ H2SO4→ + K2SO4+ Cr2(SO4)3+
C+ K2Cr2O7+ H2SO4→ + K2SO4+ Cr2(SO4)3+
(1)完成并配平上述反应的化学方程式,标出电子转移的数目和方向。
(2)此反应的氧化剂是 ,氧化产物是 。
(3)H2SO4在上述反应中表现出来的性质是 (填选项编号)
A、酸性 B氧化性 C吸水性 D脱水性
(4)上述反应中若产生0.1mol气体物质,则转移电子的物质的量是 mol。
23.如图是元素周期表框架
(1)在上面元素周期表中画出主族元素与副族元素的分界线。
(2)下列说法正确的是 。
A.周期表中的主族都有非金属元素 B.周期表中的主族都有金属元素
C.周期表中的非金属元素都位于短周期 D.周期表中的非金属元素都位于主族
(3)现有甲、乙两种元素,甲元素原子核外2p亚层上有4个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填元素符号),
写出可以验证该结论的一个化学反应方程式 。
③ 甲乙两种元素反应可能生成的产物是 。
第Ⅱ卷(共84分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com