
题目列表(包括答案和解析)
8.几种短周期元素的原子半径及主要化合价见下表:
|
元素代号 |
L |
M |
Q |
R |
T |
|
原子半径/nm |
0.160 |
0.143 |
0.102 |
0.089 |
0.074 |
|
主要化合价 |
+2 |
+3 |
+6、-2 |
+2 |
-2 |
下列叙述正确的是 ( )
A.L、R的单质与稀盐酸反应R比L更剧烈
B.M与T形成的化合物有两性
C.Q、T两元素的氢化物稳定性Q>T
D.L与T形成化合物固态时是原子晶体
7.室温时,向体积为V1、浓度为c1、pH=a的CH3COOH溶液中加入体积为V2、浓度为c2、pH=b的NaOH溶液,充分反应。下列关于反应后混合液的叙述一定正确的是 ( )
A.若pH=7,且V1=V2,则c1>c2
B.若pH<7,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
C.若c1=c2,且V1=V2,则a+b=14
D.若pH>7,且V1=V2,则c1<c2
6.用NA表示阿伏加德罗常数的值,下列说法正确的是 ( )
A.1mol -OH(羟基)中含有电子数为9NA
B.1 L 1mol/L 的氯化铁溶液中含有铁离子的数目为NA
C.7.1g氯气与足量氢氧化钠溶液反应转移的电子数为0.2NA
D.标准状况下,11.2 L SO3所含的分子数为0.5NA
5.能正确表示下列化学反应的离子方程式是 ( )
A.饱和石灰水跟稀硝酸反应 Ca(OH)2+2H+= Ca2++2H2O
B.硫酸铝溶液加过量的氢氧化钠 Al3+ + 3OH- = Al(OH)3↓
C.将硫酸氢钠滴加到氢氧化钡溶液中至溶液呈中性
Ba2++2OH-+2H++SO42-= BaSO4↓+ 2H2O
D.用大理石与盐酸制取二氧化碳:CO32-+2H+=H2O+CO2↑
4.下列离子一定能够大量共存的是 ( )
A.Na+、Al3+、Cl-、HCO3- B.Na+、OH-、NH4+、Ba2+
C.H3O+、NO3-、Fe2+、Na+ D.K+、AlO2-、NO3-、OH-
3.已知2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O;下列叙述不正确的是( )
A.实验室中不能用盐酸来酸化高锰酸钾
B.利用该反应制取氯气时,与用二氧化锰和浓盐酸制氯气实验装置完全相同
C.结合已有知识可以判断氧化性强弱顺序为:MnO4->MnO2>Cl2>Fe3+
D.该反应中1mol还原剂失去1mol电子
2.少量铁粉与100mL 0.01mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变 H2 的产量,可以使用如下方法中的 ( )
①加H2O ②加NaOH 固体③滴入几滴浓盐酸④加CH3COONa 固体⑤加NaCl 溶液
⑥滴入几滴硫酸铜溶液⑦升高温度(不考虑盐酸挥发)⑧改用10mL 0.1mol/L盐酸
A.①⑥⑦ B.③⑤⑧ C.③⑦⑧ D.⑤⑥⑧
1.下列有关叙述中,不正确的是 ( )
A.可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大
B.开发利用绿色能源(例如太阳能)替代化石燃料是人类可持续发展的必由之路
C.皮肤上不慎沾了苯酚,应立即用酒精清洗
D.石油蒸馏实验中,温度计必须插入液体中部
29.(17分)已知:
|
名称 |
化学式 |
颜色、状态 |
溶解性(g) |
熔点(℃) |
密度(g/cm3) |
|
乙二酸 |
H2C2O4 |
- |
8.6(20℃) |
189.5 |
1.900 |
|
二水合乙二酸 |
H2C2O4·2H2O |
无色晶体 |
- |
101.5 |
1.650 |
注:乙二酸( HOOC-COOH)俗称草酸,带2个结晶水的乙二酸俗称草酸晶体,草酸晶体失去结晶水得无水草酸,在约157℃时升华,其盐草酸钙和草酸氢钙均为白色不溶物。
根据上述信息,回答下列问题。
(1)向盛有Na2CO3粉末的试管里加入约3mL乙二酸溶液,观察到的现象是 ,说明乙二酸的酸性比碳酸 (填“强”或“弱”)。
(2)向盛有5mL乙二酸饱和溶液的试管里滴入3滴用硫酸酸化的0.5%(质量分数)的高锰酸钾溶液,振荡,观察到的现象为 ,说明乙二酸
有 性。
(3)向A试管中加入3mL乙醇,然后边振荡试管边加入2mL浓硫酸和2mL乙二酸,按下图甲连接好装置,加热3-5min,在B管中有油状且带有香味的液体产生,该现象说明发生
了 反应(填有机反应类型)。在B试管中加入饱和Na2CO3溶液的目的是
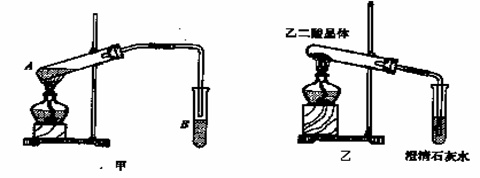 ,导管在液面上的原因是 。
,导管在液面上的原因是 。
(4)已知草酸分解的化学方程式为: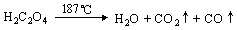 ,
,
用图乙装置加热草酸晶体,验证草酸受热分解及其产物,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,分析不合理原因 (从下列序号中选择)。
a.草酸晶体的熔点低,未分解之前就已融化并流到试管口,不利于化学反应的进行及实验现象的观察
b.因为加热的是草酸晶体,所以该装置最多只能检验一种分解产物,不能检验是否还有其他分解产物
c.在未洗气的情况下通入石灰水,还可能因草酸蒸气与石灰水反应生成草酸钙沉淀,对实验有干扰
(5)该装置也不符合绿色化学的要求,试说明原因 。
28.(14分)镁、铝、铁是重要的金属,在工业生产中用途广泛。
(1)镁与稀硫酸反应的离子方程式为 ;
(2)铝与氧化铁发生铝热反应的化学方程式为 ;
(3)在潮湿的空气里,钢铁表面有一层水膜,很容易发生电化学腐蚀。其中正极的电极反应为 ;
(4)在海洋工程上,通常用铝合金(Al-Zn-Cd)
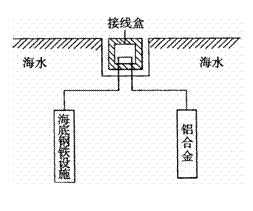 保护海底钢铁设施,其原理如图18所示:
保护海底钢铁设施,其原理如图18所示:
其中负极发生的电极反应为
;
在实际应用中,用铝合金而不选用纯铝。
纯铝不能很好地起到保护作用,其原因是
。
(5)将11.9g Mg-Al-Fe组成的合金溶于足量NaOH溶液中,合金质量减少2.7g。另取等质量的合金溶于过量的稀硝酸中,生成6.72L(标准状况)NO,向反应后的溶液中加入适量的NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com