
题目列表(包括答案和解析)
1.据报道,用10B合成的10B20有较好的抗癌作用。则下列叙述中正确的是
A.10BF3和CF4一样,分子中各原子最外层均满足8电子结构
B.10B20的中子数和核外电子数相等
C.10B20晶体的熔点高,硬度大
D.10B和10B20互为同位素
28(A)(10分)已知:
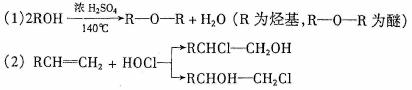
石油裂解得到C2H4可以合成很多物质,如下图:
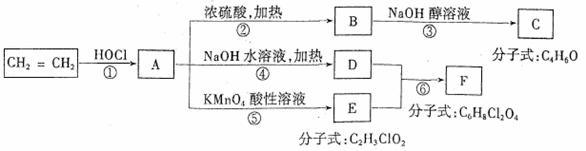
回答下列问题:
(1)写出结构简式F 。
(2)写出与A互为同分异构体的有机物结构简式有: 。
(3)上述反应中属于取代反应的是 (填反应序号①②③④⑤⑥)。
(4)写出B C的化学方程式
C的化学方程式
。
(5)反应③中将B与NaOH的乙醇溶液共热,为检验生成产物C(已知:C的沸点小于40℃),某同学认为:将生成气体通入高锰酸钾酸性溶液中,若高锰酸钾溶液褪色,可证明有C生成。该同学的想法是否正确?若不正确,说明理由 。
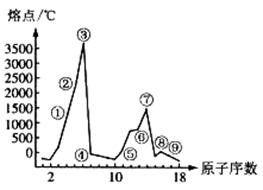
28(B)(10分)(1)下图是部分元素的单质熔点的变化图,根据此图,填写下列空格:
⑦号元素的电子排布式为___________。②、④两元素形成的化合物其晶体有两种结构,其中一种结构与金刚石相似,该结构的晶体属__________晶体,若使其熔化,需破坏的作用力为__________。
(2)参照表中物质的熔点,回答有关问题:
|
物质 |
NaF |
NaCl |
NaBr |
NaI |
NaCl |
KCl |
RbCl |
CsCl |
|
熔点℃ |
995 |
801 |
755 |
651 |
801 |
776 |
715 |
646 |
|
物质 |
SiF4 |
SiCl4 |
SiBr4 |
SiI4 |
SiCl4 |
GeCl4 |
SnCl4 |
PbCl4 |
|
熔点℃ |
-90.2 |
-70.4 |
5.2 |
12.05 |
-70.4 |
-49.5 |
-36.2 |
-15.0 |
①____________越大,________________越弱,故钠的卤化物及碱金属的氯化物的熔点依次降低。
②__________________越大,___________________越大,故硅的卤化物及硅、锗、锡、铅的氯化物的熔点依次升高。
③ 钠的卤化物的熔点比相应硅的卤化物的熔点高得多,这是由于_______________
______________________________________________________________。
27.(10分)柠檬酸结构简式如下:
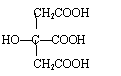
若将柠檬酸加热到150℃,则分子内失去一分子水而形成不饱和酸--顺乌头酸,后者在一定条件下会和水反应又生成柠檬酸和异柠檬酸两种异构体。
(1)写出顺乌头酸和异柠檬酸的结构简式:
顺乌头酸: 异柠檬酸: 。
(2)由柠檬酸转化为顺乌头酸的反应过程,属于 反应(填反应类型),
顺乌头酸转化为柠檬酸和异柠檬酸的反应过程,属于 反应(填反应类型)。
(3)传统塑料增塑剂为邻苯二甲酸双酯(DEHP)。因其结构中含苯环,可能致癌。柠檬酸酯无毒无味,可替代传统增塑剂。请写出用柠檬酸合成柠檬酸三乙酯(TEC)的化学方程式:
。
26.(11分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
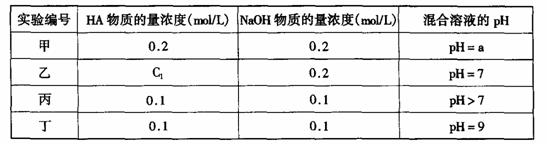
请回答:
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸
。
(2)不考虑其它组的实验结果,单从乙组情况分析,C1是否一定等于0.2mol/L (选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是 酸(选填“强”或“弱”)。
该混合溶液中离子浓度由大到小的顺序是
(4)丁组实验所得混合溶液中由水电离出的c(OH-)= mol/L
写出该混合溶液中下列算式的精确结果(不能做近似计算,回答准确值,结果不一定要化简)。
c(Na+)-c(A-)= mol/L
25.(10分)下图是部分短周期元素的单质及其化合物的转化关系图(有关反应的重要条件及生成的水已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体。(b)反应①、②是化工生产中的重要反应。(c)化合物E是形成酸雨的污染物之一,化合物K是常见的氮肥。(d)化合物L可用于漂白,可由Cl2与NaOH溶液反应制得。(e)化合物J由C、D两种元素组成,其相对分子质量为32。
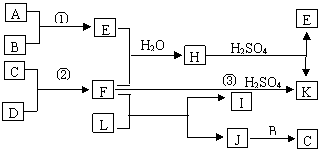
请按要求填空:
(1)反应③的化学方程式 。
(2)C的结构式 ;H的化学式 。
(3)L溶液与化合物E反应的离子方程式 。
(4)化合物J的化学式 。
24.(10分)短周期的四种元素A、B、C、D,原子序数依次增大。A、B、C三种元素原子核外电子层数之和是5。A、B两元素原子最外电子层上电子数之和等于C元素原子最外电子层上的电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A和C可以形成化合物CA3;B与D的原子序数之比为3︰4。请回答:
(1)写出化合物CA3的电子式: 。
(2)由四种元素中的三种组成的甲、乙两种化合物,甲属于盐类,其溶液呈酸性,请用离子方程式表示其溶液呈酸性的原因 。
乙为常见的天然高分子化合物,写出该高分子化合物充分水解的化学方程式:
(3)丙、丁两种化合物,它们均含上述四种元素,既可以与盐酸反应又可以与NaOH溶液反应,丙为无机盐,其化学式为 ,丁为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)A和B组成的化合物M,分子中A与B的原子个数比是3︰1,常温常压下,0.5 mol M完全燃烧放出780 kJ的热量,请写出表示M燃烧热的热化学方程式:
23.(9分)某化学兴趣小组按照下列方案进行“由含铁废铝制备硫酸铝晶体”的实验:
步骤1:取一定量含铁废铝,加足量的NaOH溶液,反应完全后过滤。
步骤2:边搅拌边向滤液中滴加稀硫酸至溶液的pH=8-9,静置、过滤、洗涤。
步骤3:将步骤2中得到的固体溶于足量的稀硫酸。
步骤4:将得到的溶液蒸发浓缩、冷却、结晶、过滤、干燥。
请回答以下问题:
⑴上述实验中的过滤操作需要玻璃棒、____________、____________等玻璃仪器。
⑵步骤1过滤的目的是_________________________________________。
⑶当步骤2中的溶液pH=8-9时,检验沉淀是否完全的方法是______________________。
⑷步骤2中溶液的pH控制较难操作,可改用_________。有关反应的化学方程式为
。
22.(8分)各地电视台的天气预报中都要预报城市的空气质量。预报中一般将城市空气中的SO2含量和可吸入颗粒的含量(可用g/cm3表示)分为8个等级。目前,测定空气中SO2含量时主要用一些氧化还原法。
已知:SO2气体与酸性KMnO4溶液反应时,MnO4-被还原为Mn2+,SO2被氧化为SO42-。
现有药品:KMnO4固体、硫酸、颗粒吸附剂、品红试纸、pH试纸。
完成下列各题:
(1)配制250mL0.100mol/L的酸性KMnO4溶液需用的仪器有 、 、玻璃棒、胶头滴管、烧杯、量筒等。玻璃棒的作用是 和 。
(2)写出SO2与酸性KMnO4溶液反应的离子方程式:
;
(3)向200mL0.1mol/L的酸性KMnO4溶液通入空气至恰好褪色,若气体的流速为a cm3/min,当t min时,则空气中SO2的含量为 g/cm3 。
21.(12分)已知氨气跟氧化铜反应可以制备氮气,有关化学方程式:
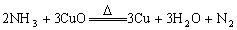 ,
,
纯氮气跟镁在高温下反应可得到氮化镁,但氮化镁遇水即剧烈反应生成氢氧化镁和氨气。
(1)下面是某化学课外小组的同学提出的实验制备氨气的几种方案
A.硫酸铵固体与消石灰共热 B.浓氨水逐滴加到新制的生石灰中
C.在一定条件下,氮气与氢气化合 D.加热分解氯化铵固体
你认为其中合理的方案有________________________(填字母);其反应的化学方程式为:_________________________________________________________________。
(2)该小组同学设计的制备氮化镁的方案有以下两个。分别见实验方案的装置图。且在实验前系统内的空气均已排除。
[方案一]
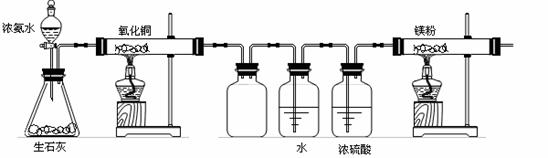
A B C D E F
①该实验完成后,能否得到纯净的氮化镁____________(填“能”或“不能”);简述理由__________________________________________________________________________。
②装置C的作用是____________________________________。
[方案二]
已知: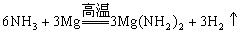
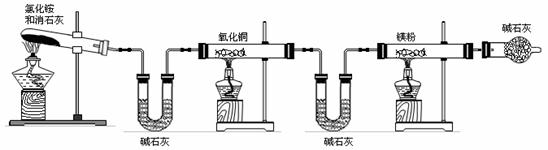
A B C D E F
①该方案中存在的主要问题是________________________________________________
____________________________________________________________。
②如何才能解决上述问题________________________________________________。
20.用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是:
①加盐酸溶解 ②加烧碱溶液溶解
③过滤 ④通入过量CO2生成Al(OH)3沉淀
⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液
A.①⑥⑤③ B.②③⑤③ C.②③④③ D.①③⑤③
第II卷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com