
题目列表(包括答案和解析)
26.(10分) (1)K= , (2) (3)
(4)
25. (10分)⑴ ,
⑵ ;
。
⑶
⑷
24、(共7分)
(1) , (2) ,(3) , (4) ,
(5) , (6) ,(7) 。
23.(8分)
(1) , , ;
(2) ;(3) , 。
(4) 。
22.(12分)
(1) 。
(2)①
② 。
③ 。
(3) 。(4) 。
21.(13分) (1) 、
(2) 、
(3) ,
(4) , 。
(5): (6) 、 。
28.(10分)U、V、W、X、Y、Z是原子序数依次增大的六种常见元素。Y的单质在W2中燃烧的产物可使品红溶液褪色。Z和W元素形成的化合物Z3W4具有磁性。U的单质在W2中燃烧可生成UW和UW2两种气体。X的单质是一种金属,该金属在UW2中剧烈燃烧生成黑、白两种固体。
请回答下列问题:
⑴.V的单质分子的结构式为_________;XW的电子式为_______;Z元素在周期表中的位置是_______。
⑵.U元素形成的同素异形体的晶体类型可能是(填序号)__________。
① 原子晶体 ② 离子晶体 ③ 分子晶体 ④ 金属晶体
⑶.U、V、W形成的10电子氢化物中,U、V的氢化物沸点较低的是(写化学式)____;V、W的氢化物分子结合H+能力较强的是(写化学式)__ _,用一个离子方程式加以证明_____________________。
⑷.YW2气体通人BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体VW,有关反应的离子方程式为_________________,由此可知VW和YW2还原性较强的是(写化学式)______________________。
2008届高三基本概念基本理论专题测试卷答题卷
27. (10分) 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(10分) 二氧化硫和氮的氧化物是常用的工业原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化成SO3:2SO2(g)+O2(g) 2SO3(g)
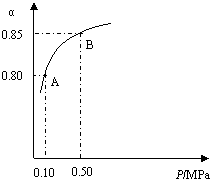 某温度下,SO2的平衡转化率(α)与体系总压强
某温度下,SO2的平衡转化率(α)与体系总压强
(P)的关系如右图所示。根据图示回答下列问题:
①将2.0mol SO2和1.0mol O2置于10L密闭容器中,反应达平衡后,
体系总压强为0.10 MPa。该反应的平衡常数等于 。
②平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为 (阿伏伽德罗常数用NA表示),放出的热量为 kJ。
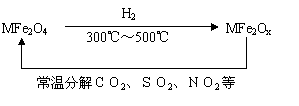 (3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox 3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
请写出MFe2Ox分解SO2的化学方程式 (不必配平)。
26.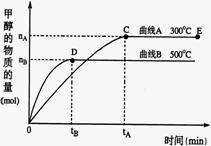 (10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
(10分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)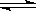 CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
(1)反应达到平衡时,平衡常数表达式K= ,升高温度,
K值 (填“增大”、“减小”或“不变”)。
(2)在500℃,从反应开始到平衡,氢气的平均反应速率
v(H2)=
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是
a 氢气的浓度减少 b 正反应速率加快,逆反应速率也加快
c 甲醇的物质的量增加 d 重新平衡时n(H2)/n(CH3OH)增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是: (用化学方程式表示)。
25.(10分)有四种同主族物质,它们的沸点(℃,1.01×105pa)如下表所示:
|
① |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
② |
F2 -187.0 |
Cl2 -33.6 |
(a) 58.7 |
I2 184.0 |
|
③ |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
④ |
H2O (z) |
H2S -60.2 |
(b) -42.0 |
H2Te -1.8 |
试根据上表回答:
⑴a为 色液体,b的分子式是:
⑵写出②系列中物质主要化学性质的递变规律(任定一种): ;
能够说明该递变规律的化学事实是(任举一例,用离子方程式表示):
。
⑶除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该
关系是:
⑷上表中,和两种物质的沸点较同系列其他物质反常,反常的主要原因是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com