
题目列表(包括答案和解析)
22、(12分)市售果汁通常是由鲜果汁加以各种辅料配制而成。某实验活动小组想探究果汁中的主要成份,经查阅有关资料,结合所学知识和中学实验室条件,准备测定果汁中维生素C的含量和总酸量。
资料显示,果汁中维生素C的含量可由如下反应原理测得:
C6H8O6+I2→C6H6O6+2H++2I-
⑴补齐下列步骤中所缺部分
①检查滴定管是否漏液。
②将 式(填酸式、碱式)滴定管洗净后用待测果汁润洗二次,装入果汁。
③从上述滴定管中向两只锥形瓶中分别放入各20.00 mL果汁,盖上橡胶塞备用。
④取一只③中装有果汁的锥形瓶,向其中加入10mL经煮沸、冷却后的蒸馏水,5mL6mol/L的醋酸,3mL0.5%的 作指示剂,用0.05000mol/L的碘水溶液滴定至溶液呈 色且半分钟不褪。记下所消耗碘水的体积为VmL。
⑤取③中所备另一只装有果汁的锥形瓶,用0.0500mol/ LNaOH标准溶液滴定,消耗标准NaOH溶液12.80mL。
⑵回答下列问题:
①⑴中步骤④所加蒸馏水为什么要经煮沸后冷却再使用 ,若未经煮沸对测定结果有何影响 。
②现有两个实验小组用同一种果汁同时进行实验,两组的测定数据如下:
|
|
甲组 |
乙组 |
||||
|
第1次 |
第2次 |
第3次 |
第1次 |
第2次 |
第3次 |
|
|
试样体积(mL) |
20.00 |
20.00 |
20.00 |
20.00 |
20.00 |
20.00 |
|
标准I2液体积(mL) |
6.58 |
7.22 |
6.66 |
6.76 |
6.78 |
6.74 |
如果你是教师,你在准备实验时多次测定的平均值是V=6.82mL,根据上述两个小组的实验数据,
A、你对 小组的评价更高,理由是 。
B、以你认为较为可靠的一组数据计算该果汁中维生素C的含量(单位:g/L)。
③中学实验室进行酸碱中和滴定时,常用酚酞或甲基橙为指示剂。本实验中测定果汁中总酸量时应选用 做指示剂?理由是 。
21.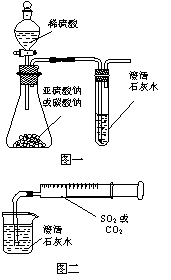 (7分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2看不到浑浊现象。
(7分)某同学用如图一所示的装置来探究CO2、SO2与澄清石灰水的反应,结果通入CO2可以看到先浑浊后澄清的现象,但通入SO2看不到浑浊现象。
经思考后该同学改用图二的装置,将气体收集在 注射器,缓慢地将气体一个气泡一个气泡地通入澄清石灰水中,都能看到石灰水先变浑浊再澄清的现象,且通入SO2时产生现象明显比通入CO2快。
(1)对比分析两组实验,你认为用图一装置实验时, 通入SO2不能出现浑浊的原因可能是: 。
(2)用图二装置实验时,以相同速率通入CO2或SO2,SO2产生浑浊、澄清的现象比CO2快的原因是 。
(3)用图一装置进行SO2与石灰水反应的实验若存在缺陷,其改进方法是(若你认为该装置没有缺陷,此空可以不填): 。
20.在体积都为1L,pH =2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是
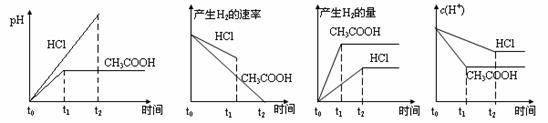
A B C D
第Ⅱ卷 非选择题(共80分)
19.下列实验不能达到预期目的的是
|
序号 |
实验操作 |
实验目的 |
|
A |
Cl2、Br2分别与H2反应 |
比较氯、溴的非金属性强弱 |
|
B |
MgCl2、AlCl3溶液中分别通入NH3 |
比较镁、铝的金属性强弱 |
|
C |
测定同浓度Na2CO3、Na2SO4两溶液的pH |
比较碳、硫的非金属性强弱 |
|
D |
用同一电路测定相同pH的盐酸、醋酸两溶液的导电性 |
比较盐酸、醋酸的酸性强弱 |
18.化学上鉴定S2O32- 的方法之一,是使用AgNO3溶液作试剂。将AgNO3 溶液逐渐滴入含有S2O32- 的溶液中时,会有以下反应发生:
Ag++2S2O32-=[Ag(S2O3)2]3-
3Ag++[Ag(S2O3)2]3-=2Ag2S2O3↓(白)
Ag2S2O3+H2O=Ag2S↓(黑)+H2SO4
对于鉴定S2O3-的下列叙述不正确的是
A.该鉴定可在酸性或碱性溶液进行
B.该鉴定只能在中性溶液中进行
C. AgNO3必须过量
D. S2- 对该鉴定有干扰
17.科学家预言超级原子的发现将会重建周期表,2005年1月美国科学家在《Science》上发表论文,宣布发现铝的超原子结构A113和A114,并在质谱仪检测到稳定的A113- 、Al142+等。A113、A114的性质很像现行周期表中的某些主族元素,已知这类超原子当具有40个价电子时最稳定。下列说法不正确的是
A、A113与卤原子性质类似,A113- 性质不活泼
B、A114在气态中与HI反应的方程式可表示为:A114+3HI=HAl14I3+H2
C、A113超原子中A1原子间是通过离子键结合的
D、All4与ⅡA族元素性质相似,容易失去2个电子而形成稳定的All42+
16.能正确表示下列反应的离子方程式的是
A.向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B.硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.少量固体Mg(OH)2溶于饱和NH4Cl溶液中:
2NH4++Mg(OH)2=2NH3·H2O+Mg2+
D.用惰性电极电解MgCl2溶液:2Cl-+2H2O  H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
15.下列各组离子,在溶液中一定能大量共存的是
A.pH=1的溶液中:NO3-、I-、Fe2+、K+
B.与铝反应放出H2的溶液中:SO42-、Cl-、Fe3+、Mg2+
C.pH=14的溶液中:SO32-、S2-、Na+、K+
D.由水电离出的c(H+)=10-14mol/L的溶液中:CO32-、SO42-、Na+、K+
14.2005年10月12日我国成功发射了第二艘载人航天飞船--“神州六号”,实现了双人多天太空旅行。这标志着中国人的太空时代又前进了一大步。发射“神六”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g) + 2O2(g) = 2NO2(g); △H = + 67.7kJ/mol
N2H4(g) + O2(g) = N2(g) + 2H2O(g); △H = – 534kJ/mol
下列关于肼和NO2反应的热化学方程式中,正确的是
A、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C、N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D、2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol
13.如图所示,活塞a开始时处于关闭状态,将液体A 滴入试管乙中,与气体B充分反应后,打开活塞,可发现试管甲中的水立即沸腾了,则液体A和气体B 的组合可能的是:
A、氢氧化钠溶液、一氧化氮 B、水、二氧化碳
C、氯化钠溶液、氨气 D、新制氯水、甲烷
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com