
题目列表(包括答案和解析)
1.化学是一门实用的、中心的学科,生活中的许多问题常涉及到化学知识。它在给经济发展
和生活带来方便的同时,如果运用不当也会产生负面的影响。下列有关叙述不正确的是
A.次氯酸和臭氧都是强氧化剂,都能杀死水中的细菌。自来水常用氯气来杀菌消毒,是因为氯气杀菌消毒效果要比臭氧好,且不会残留有毒、有害物质
B.人们应用原电池原理,制作了多种电池,如干电池、充电电池、高能电池等。电池在现代生产和科学技术中发挥了重要作用,但废旧电池会对生态环境和公众健康造成危害。所以废旧电池必须回收再利用
C.明矾常用作净水剂,但人体摄入大量铝盐,易患“老年性痴呆”,所以饮用水的生产不能大量采用明矾作净水剂
D.氟氯烃为一类含有氟和氯的有机物,是制冷效果极佳的致冷剂,但它会破坏臭氧层,科研人员正在积极研发环保型的替代产品以减少氟氯烃的使用量
25.(8分)某硫酸厂用接触法制硫酸的生产过程中
(1)若灼烧6g FeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(2)煅烧10t含FeS290.0%的黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸质量为 t,SO2全部转化为H2SO4时放出的热量是 kJ。
24.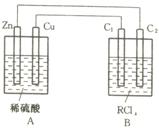 (4分)某金属R的氯化物RClx13.5g溶于水配成0.100 mol·L-1的水溶液1.00L。取该溶液放入下图的B烧杯中,电解一段时间,若Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g。求金属R的相对原子质量。
(4分)某金属R的氯化物RClx13.5g溶于水配成0.100 mol·L-1的水溶液1.00L。取该溶液放入下图的B烧杯中,电解一段时间,若Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g。求金属R的相对原子质量。
23.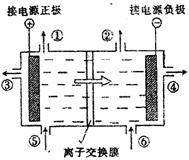 (12分)右图是目前世界上比较先进的电解制碱技术-离子交换膜法的示意图。精制饱和食盐水,纯水(含少量NaOH)分别加入上述电解槽中,可以得到气体产物①、②以及NaOH溶液,电解后的淡盐水从电解槽中导出可重新用于配制食盐水。根据上述信息回答下列问题:
(12分)右图是目前世界上比较先进的电解制碱技术-离子交换膜法的示意图。精制饱和食盐水,纯水(含少量NaOH)分别加入上述电解槽中,可以得到气体产物①、②以及NaOH溶液,电解后的淡盐水从电解槽中导出可重新用于配制食盐水。根据上述信息回答下列问题:
(1)在电解过程中,与电源正极相连的电极上所发生的方程式 。与电源负极相连的电极负极溶液PH值 (填:不变,升高或降低)。
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填a、b、c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂,最后加入盐酸
b.先加NaOH,后加钡试剂,再加Na2CO3,最后加入盐酸
c.先加钡试剂,后加NaOH,再加Na2CO3,最后加入盐酸
(4)溶液中的Na+、H+、Cl_、OH_能通过离子交换膜的是________________。
(5)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为_____________________。
22.(6分)近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。氢是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的所谓“二级能源”,而存在于自然界的可以直接提供现成形式能量的能源称为一级能源,如煤、石油、太阳能等。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是________________。
A.电解水 B.锌和稀硫酸反应
C.光解海水 D.以石油、天然气为原料
(2)氢气燃烧时耗氧量小,发热量大。已知,热化学方程式为:
H2(g)+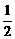 O2(g)===H2O(l) ΔH=-285.8
kJ·mol-1 C(g)+O2(g)===CO2(g) ΔH=-393.5
kJ·mol-1
O2(g)===H2O(l) ΔH=-285.8
kJ·mol-1 C(g)+O2(g)===CO2(g) ΔH=-393.5
kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比是_____________________(列出计算式)。
(3)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物),在这类氢化物中,氢原子填充在金属的晶格间隙之间,其组成不固定,通常是非化学计量的,如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g/cm3,相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式______。
21. (8分)工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度
会自行降低,并析出晶体。导致溶液温度降低的原因可能是 ;
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
20.(8分)A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中A、C及B,D分别是同一主族元素,B、D元素的原子核中质子数之和是A、C两元素原子核中质子数之和的两倍,又知四种元素的单质中有两种气体、两种固体。请回答:
(1) C、D组成的常见化合物,其水溶液呈碱性,原因是 ______________________。
(用离子方程式表示)。
(2)4.0 g D单质在足量的B单质中完全燃烧,放出37 kJ热量,写出其热化学方程式: 。
(3)用A元素的单质与B元素的单质可以制成电池,电池中装有KOH浓溶液,用多孔的金属惰性电极浸入KOH溶液,两极均有特制的防止透过的隔膜,在A极通入A的单质,B极通入B的单质,则A极是该电池的 极;B极的电极反应式是 。
19.(8分)有四种同族(系列)的物质,它们的沸点(温度/℃,压强为1.01×105Pa)如下表所示:
|
1 |
He -268.8 |
Ne -249.5 |
Ar (x) |
Kr -151.7 |
|
2 |
F2
-187.0 |
Cl2
-33.6 |
(a) 58.7 |
I2 184.0 |
|
3 |
HF (y) |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
|
4 |
H2O
(z) |
H2S
-60.2 |
(b) -42.0 |
H2Te
-1.8 |
试根据上表回答下列问题:
(1)写出系列2中物质主要化学性质的递变规律(任写1种)__________________________。
(2)除极少数情况外,上述四种系列中物质的沸点与相对分子质量之间均存在一定的关系,该关系是________________________________________________;
(3)上表中,_________和________(写化学式)两种物质的沸点较同系列其它物质反常,反常的主要原因是____________ 。
18.在盛有饱和Na2CO3溶液的烧杯中,插入惰性电极,保持温度不变,通电一定的时间后,下列判断正确的是
A.溶液的pH将增大 B.溶液中Na+数和CO32-数的比值将变小
C.溶液浓度不变,有晶体析出 D.溶液浓度逐渐增大并有晶体析出
17.参照反应Br + H2 = HBr +H的能量对反应历程的示意图, 下列叙述中正确的是
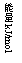
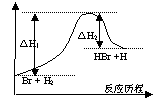 A. 正反应为吸热反应
A. 正反应为吸热反应
B. 加入催化剂,该化学反应的反应热变大
C. 正反应为放热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com