
题目列表(包括答案和解析)
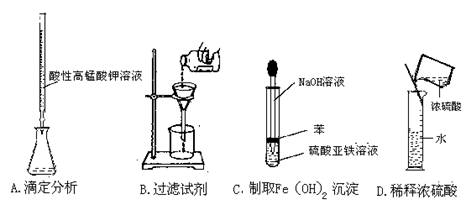
5.下列实验操作或者仪器的用法中正确的是
4.室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.MnO4-、Cl-、Fe2+、K+ D.SiO32-、SO32-、Na+、Cl-
3.赤铜矿的成份是Cu2O,辉铜矿的成份是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:2Cu2O + Cu2S  6Cu + SO2↑,对于该反应,下列说法正确的是
6Cu + SO2↑,对于该反应,下列说法正确的是
A.该反应的氧化剂只有Cu2O
B.该反应中氧化产物与还原产物的质量比为1∶6
C.每生成1 mol Cu,还原剂转移给氧化剂的电子为2 mol
D.Cu既是氧化产物,又是还原产物
2.某同学利用中学化学教材中提供的数据或图表进行如下推理和判断,其中错误的是
A.依据中和热的数据,推算一定量的H2SO4和NaOH的两种稀溶液反应放出的热量。
B.依据沸点的数据,判断将两种互溶的液态混合物用蒸馏方法分离开来的可能性。
C.依据相对分子质量,一定能判断组成和结构相似的物质熔沸点的高低。
D.依据元素的原子结构,可以推知其在元素周期表中的位置。
1.下列说法中正确的是
A.用在航天器中的抗氧化陶瓷复合材料属于无机非金属材料
B.提倡使用乙醇汽油主要是为了提高汽油的燃烧效率
C.赤潮、潮汐、酸雨、臭氧层空洞都是与环境污染有关的现象
D.香烟包装用的“锡纸”是在纸上镀锡制成的
23.(12分)将一定质量、密度为1.11g·cm-3的食盐水用石墨电极进行电解,一段时间后停止通电,测得剩余溶液中溶质的质量分数为22.5%。若向剩余溶液中加入18g溶质质量分数为36.5%的盐酸,能使溶液恢复为电解前的组成。
(1)写出电解过程中发生的两个反应的化学方程式。
(2)计算电解过程中电路中通过的电子的物质的量。
(3)计算电解前食盐水的物质的量浓度。
22.(8分)环境监测测定水中溶解氧的方法是:①量取a mL水样,迅速加入固定剂MnSO4溶液和碱性KI溶液,立即塞好瓶塞,反复顛倒振荡,使之充分反应。其反应式为:2Mn2++O2+4OH-=2MnO(OH)2(该反应极快)。②测定:开塞后迅速加入1-2mL浓硫酸(提供H+)使之生成I2,有关反应式为MnO(OH)2+2I-+4H+=Mn2++I2+3H2O,再用b mol·L-1的Na2S2O3溶液滴定(以淀粉为指示剂),消耗了VmL溶液,滴定中S2O32-离子变成了S4O62-离子。试写出水中溶解氧的计算式(以g·L-1为单位)。
21.(14分)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,该溶液中各离子浓度的大小关系可能有下列4种情况:
①c(Cl-)>c(H+)>c(NH4+)>c(OH-) ②c(Cl-)>c(NH4+)>c(H+)>c(OH-)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+) ④c(H+)+c (NH4+)=c(OH-)+c(Cl-)
请填写下列空白:
(1)若该溶液中只溶解了一种溶质,则该溶质是________,此时上述关系中,能表示该溶液中4种离子浓度关系的有_____ ___(填序号),用惰性电极电解该饱和溶液的化学方程式是_____ ___ ____ _;
(2)试再写出一个表示该溶液中离子浓度大小的关系式:____ _(与题目中提供的关系式不能重复)。则此时该溶液中的溶质是____ ____。若该溶液是体积相等的稀盐酸和氨水混合而成,且混合后pH=7,则混合前c(HCl)____ __c(NH3)(填“>”、“=”或“<”,下同),混合前盐酸中c(H+)和氨水中c(OH-)的关系为c(H+)__ __c(OH-)。
20.(14分)右图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,常温下为气体。J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)请按要求回答:
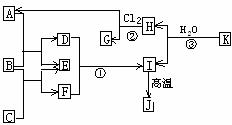 (1)写出B的化学式__________________,
(1)写出B的化学式__________________,
G的电子式______________________。
(2)反应①的离子方程式_________ ____。
(3)反应②的反应类型是_________,进行的条件是__________、____________。
(4)反应③的化学方程式为____________________________________。
19.(4分)将4g甲烷和适量氧气混合后通入密闭容器中,点燃使之恰好完全反应,待恢复到原温度后,测得反应前后压强分别为3.03×105Pa和1.0l×105Pa,同时测得反应共放出222.5KJ热量。试根据上述实验数据,写出该反应的热化学方程式: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com